得益于 DNA 合成、測序技術的發展和成本的降低,加之基因組學和數據科學也在飛速發展,所以合成生物學的應用範圍在過去十年中迅速擴大。合成生物學可以設計新的生物系統、或者重新設計現有的系統,使之實現人類所需的特性和新功能,從而應用在疾病診斷、制造業、農業和醫學等多個領域。
在制藥領域,藥物開發的過程耗時、昂貴且極具挑戰性,且成功率很低。如何將合成生物學應用在藥物開發過程中,提高藥物開發的效率和成功率,這被寄予了很高的期望。
來自新加坡國立大學的 Andy Tay 近日發表了一篇分析文章,詳細解讀了合成生物學如何應用于藥物開發的各個階段,即從闡明疾病機制,到確定藥物靶點,再到規模化生産藥物。
圖 | Andy Tay(來源:Linkedin)
Andy Tay 現任新加坡國立大學生物醫學工程系助理教授,他在新加坡國立大學獲得生物醫學 / 醫藥工程學學士學位,隨後在 UCLA 攻讀生物工程學博士學位,是斯坦福大學博士後學者、倫敦帝國理工學院布魯內爾研究員。他的研究方向主要是免疫工程學、磁性生物材料和力學生物學醫學。2020 年,他入選世界經濟論壇青年科學家。今年入選了《海峽時報》的 “30 and under: Young Singaporeans to watch”。
通過識別新的基因組發現天然産物
天然産物是由自然界的生物體産生的、具有藥理或生物活性的化合物,可作爲新藥的來源。天然産物比化學合成的藥物分子更複雜。
日本東北大學醫藥科學研究生院教授 Teigo Asai 說:“天然産物是曆史上獨一無二的藥物發現來源。然而,它們的獲得性較低,存在供應和模擬物合成方面的問題,這阻撓了制藥公司在藥物開發中的使用。因此,我們想要通過技術手段解決上述問題,並使我們能夠使用合成生物學方法有效地利用天然産品進行藥物發現。”
把合成生物學和基因組挖掘結合起來,可以從天然藥物産品中發現新的生物合成基因組。
生物合成基因組(biosynthetic gene cluster):生物體基因組中由兩個或更多基因組組成的一組基因,它們共同編碼一種生物合成途徑,以生産特定的代謝物。這種代謝物可能具有治療性質,可以作爲一種天然産物藥物。
利用合成生物學,Asai 和他的同事們驗證了菌類可以成爲多種天然産物的豐富來源,而用化學方法實現大量生産則很有挑戰性。
其中一個例子是 decalin-containing diterpenoid pyrones (DDPs),這是一種天然産物,具有抑制癌細胞增殖的作用。通過基因挖掘、異源和組合生物合成的方法,可以拓展 DDPs 的化學空間,可實現更廣泛的生物活性。
Asai 團隊通過基因組挖掘,在真菌中確定了假定的 DDPs 基因組,並在這些基因組中設計了 5 條通路,之後在一個異源宿主、絲狀真菌米曲黴(Aspergillus oryzae)NASR1 中逐步重建了它們。生物合成基因組來源于非培養生物體,因此在既定宿主中異源表達是必要的。合成生物學對于産生具有良好特征的底盤生物也至關重要,比如米曲黴,它可以通過基因操縱來促進藥物生産。
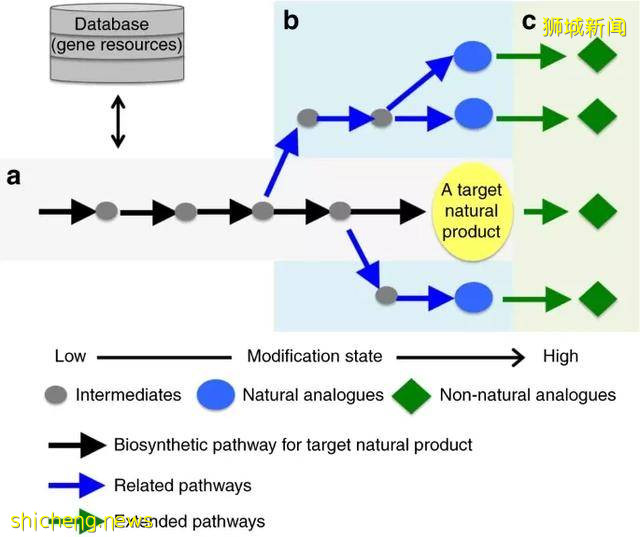
圖 | a. 目標天然産物生物合成途徑的基因組挖掘與重構。b. 基因組挖掘和重建的相關途徑,以産生自然類似物。c. 通過在天然途徑中添加額外的酶來産生非自然類似物,組合生物合成途徑的延伸。灰色圓圈、藍色圓圈和綠色菱形分別代表中間産物、自然類似物和非自然類似物。黑色、藍色和綠色箭頭分別表示目標天然産物的生物合成途徑、相關途徑和延伸途徑。(來源:Synthetic biology based construction of biological activity-related library of fungal decalin-containing diterpenoid pyrones)
Asai 團隊在這些通路中引入了其他的修飾酶,生成了 22 個 DDPs,其中 15 個類似物此前未見報道。最後,他們測試了 DDP 類似物,發現了可以抑制癌症幹細胞增殖、抑制艾滋病毒和防止澱粉樣蛋白形成的候選物。
“在這項研究中,我們展示了基于重新設計生物合成途徑的組合生物合成,有利于合理地擴展具有生物活性的天然産品的化學空間。我們還證明了這個文庫對于發現生物活性分子是有用的。”Asai 說。
Asai 團隊還進行了其他的真菌基因組挖掘,發現了一種假定的大環內酯 (一種天然産物) 生物合成基因組。他們利用振動光譜和結晶海綿法來確定化合物的立體化學性質,提出了其生物合成途徑。這項研究進一步表明,通過合成方法,細胞可以通過基因轉化産生結構複雜的生化分子。
“目前,我們正在將我們的方法擴展到其他類型的天然産物,以構建一系列的天然産物庫,以尋找藥物 “種子”,特別是針對難治性癌症和棘手的感染性疾病。此外,我們正在利用合成生物學的方法從基因組中發現和生産具有新結構和生物活性的天然産物。”Asai 說。
驗證靶點
CRISPR-Cas 是最有價值的靶點驗證工具之一。
利用 CRISPR 基因組編輯方法,研究人員已經創造出與生理和疾病更相關的細胞系,增強了在臨床前研究和臨床藥物發現階段的靶點驗證。
此前,有學者研究證實了目前正在開發的一些 RNA 幹擾藥物和小分子抑制劑所針對的靶點,可能並不會直接影響腫瘤。在這項研究中,研究人員就是利用了 CRISPR-Cas 來研究在癌症的不同發展階段,藥物與靶點之間的相互作用。
圖 | 多種抗癌藥物對非靶點細胞的殺傷。(來源:Off-target toxicity is a common mechanism of action of cancer drugs undergoing clinical trials)
CRISPR 基因編輯還可以用來識別産生耐藥性的突變。洛克菲勒大學的 Corynn Kasap 和同事開發了一種方法,將 CRISPR-Cas9 基因組編輯與高通量篩選相結合,以研究抗癌治療藥物的作用機制。在該過程中,他們利用癌症細胞株來探索這種機制是否可能導致耐藥性。
優化藥物療效
在藥物開發過程中,被驗證具有治療價值的藥物化合物會被提取,隨後生産出具有更高療效的化合物,這是典型的苗頭化合物到先導化合物的優化流程。
該過程可以通過藥物化學來實現,通過反複的化學修飾來更好地理解結構 – 活性關系和代謝穩定性。基于突變 (如易出錯的聚合酶鏈反應) 和選擇的定向進化常被用作進化遺傳編碼分子 (如蛋白質) 的方法。
近年來開發的定向進化合成生物學工具包括酵母菌體內持續進化、CRISPR 激活誘導的胞苷脫氨酶(CRISPR-activation-induced cytidine deaminase,AID)、基于正交 DNA 聚合酶 – 質粒對的 DNA 聚合酶 OrthoRep。
大規模生産
藥物能否實現規模化生産,是其能否進入市場的重要因素。CRISPR 技術可以對大腸杆菌和真菌等底盤細胞進行基因工程,之後在大型生物反應器中培養。
底盤:一種有機體,它可以容納遺傳成分,並提供一個允許它們發揮作用的環境。它們通常被使用,是因爲其基因組更容易被理解,並且它們的代謝網絡能夠有效地合成所需的産品。
酵母通常是藥物發酵的首選,因爲它們具有一些有利的特性,比如可以宿主大量的遺傳工具,只需要廉價的生長介質。
(來源:histogene)
雖然合成生物學技術已經在酵母中建立了良好的基礎,但爲哺乳動物細胞工程開發的基于 CRISPR 的基因工具包則遇到一些問題,哺乳動物細胞會排斥大腸杆菌等其他微生物。
曼徹斯特大學合成生物學教授 Eriko Takano 及其同事最近構建了一個 CRISPR-Cas12a 工具包,該工具包可以將大的 DNA 片段 (如整個代謝途徑) 整合到宿主基因組中,只需一步 (8.4 kbp)。該技術還可以在不使用增加質粒大小的遺傳標記的情況下,分別以約 80% 和 50% 的效率刪除或整合基因組。
圖 | 上述論文
“我的小組在研究用于抗生素生産的無色鏈黴菌的代謝工程。爲了有效地做到這一點,我們需要快速地添加和刪除大量的基因。新的 CRISPR-Cas9 方法非常適合這一目的,因爲它是有效的,但最初它並不適用于 S. coelolor 細菌,因爲它需要對每個細菌菌株進行仔細地優化。我們在論文中表明,可以通過微調 Cas9 表達式來實現優化。我們發現,過高的 Cas9 表達水平會對一些細菌産生毒性,而過低的水平則會阻止系統的功能,我們最終確定了在不同情況下物種特有的 Cas9 表達的最佳點。”Eriko Takano 說。
合成生物學正在引領生物制造的新時代,利用轉化的微生物作爲 “化工廠”。
面臨的挑戰
盡管合成生物學在治療方面的發展前景廣闊,但需要承認的是,目前仍然存在挑戰。
首先,基因元件很難標准化,不能簡單地在不同的細胞系統中 “即插即用”。由于對如何模擬底盤生物的認識不足,情況變得更加複雜。因此,發力方向應該是通過確定細胞活性所需的最小基因集合,能夠 “自下而上” 地構建細胞。
其次,由于環境的影響,引入細胞的遺傳電路可能不是永久性的和穩定的。這可能導致批次之間的差異,可能會影響藥物評估和生産。
第三,除了編碼基因組外,還有非編碼元件,也起到調控基因表達的作用,但是,這一過程還需要進一步研究。
最後,與工程系統不同的是,工程系統的元件可以輕微修改轉移,但生物元件不太能在底盤生物體之間轉移,因爲它們通常是不正交的,會與底盤的基因、蛋白質和代謝物相互作用。