澎湃新聞首席記者 賀梨萍
COVID-19大流行兩年多以來,SARS-CoV-2的持續變異一直是懸在“初代防疫工具箱”頭上的達摩克利斯之劍。最早在南非檢測發現的奧密克戎亞變異株BA.4、BA.5最終將這種險情推至高點。
截至目前,BA.4/5已在南非、美國、葡萄牙、英國、以色列等國成爲主要流行毒株。據世界衛生組織(WHO)7月13日最新發布的全球COVID-19疫情周報,在2022年6月10日至7月10日提交至GISAID的序列中,奧密克戎仍是全球流行的主要變異,占到84%。
在全球範圍內,奧密克戎BA.2和BA.2.12.1呈下降趨勢,而BA.4和BA.5呈上升趨勢。對第25周(2022年6月19日至25日)和第26周(6月26日至7月7日)提交給GISAID的序列進行比較,BA.2序列從7%下降到4%,BA.2.12.1序列從13%下降到7%。然而,在同一時期內,BA.4比例從11%上升至14%;BA.5從42%上升至50%。BA.5序列已在89個國家報道。
多位新冠疫苗及中和抗體開發研究人員在接受澎湃新聞(www.thepaper.cn)記者采訪時均表示,BA.4/5亞變異株對現有所有疫苗和大多數中和抗體都表現出非常厲害的免疫逃逸,“需要新的應對方案,包括開發新的疫苗。”
值得關注的是,作爲新冠疫苗開發的第一梯隊,輝瑞/BioNTech、莫德納等公司也感受到了史無前例的威脅,紛紛加緊測試此前在研的針對奧密克戎早期毒株的修改版疫苗是否能有效應對BA.4/5。同時,針對BA.4/5的特異性疫苗也在這些公司的考慮和研發之中。
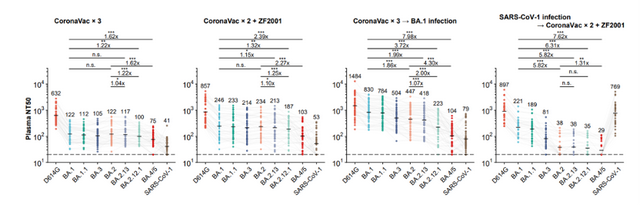
國內的相關疫苗開發團隊也在評估新的形勢。就在7月6日,中國疾控中心主任、中科院院士高福等人即在國際權威學術期刊《新英格蘭醫學雜志》(NEJM)發表了一篇文章,他們采用僞病毒分析法評估了疫苗接種者血清樣本對SARS-CoV-2原始毒株(PT)以及對奧密克戎亞型BA.1、BA.1.1、BA.2、BA.2.12.1、BA.3、BA.4和BA.5的中和抗體滴度。這些疫苗接種者接種了三劑在中國廣泛使用的滅活疫苗科興克爾來福CoronaVac、國藥BBIBP-CorV中的一種,或者三劑蛋白亞基疫苗ZF2001(智飛生物的智克威得),或者兩劑科興克爾來福加上ZF2001加強針。
北京大學生命科學學院教授、昌平實驗室領銜科學家、圓因生物科學創始人魏文勝在接受澎湃新聞(www.thepaper.cn)記者采訪時表示,團隊此前開發的基于奧密克戎變異株的環狀RNA疫苗,在BA.4/5面前保護力大打折扣,但另一款基于德爾塔變異株的環狀RNA疫苗“反而能夠提供保護”。他同時提到,“我們現在同時也在開發更廣譜的疫苗。”圓因生物于2021年4月創立于北京,利用自主研發的環狀RNA(circRNA)技術開發新冠疫苗是這家公司當前的迫切目標之一。
北京大學李兆基講席教授謝曉亮將此前的一些國內外抗體藥物被逃逸的經曆視作經驗教訓。他對澎湃新聞(www.thepaper.cn)記者表示,“一旦被逃逸了,就前功盡棄,所有的投入就付諸東流。”他同時提到,“事實上,我們已經篩選出大批這樣的高活性廣譜β冠狀病毒B譜系中和抗體並選定了候選藥物,正在准備進行臨床研究。”謝曉亮課題組參加的昌平實驗室團隊正在集中力量開發廣譜中和抗體。
複旦大學病原微生物研究所所長姜世勃教授自新冠疫情伊始,就多次呼籲要盡快地研發高效、廣譜抗新冠疫苗、抗體和藥物,應對未來的病毒變異。“但當時並未引起人們的關注,甚至還有專家認爲冠狀病毒並不易突變,如中東地區流行的MERS冠狀病毒已有8年之久,至今也沒有發生明顯變異。”姜世勃對澎湃新聞(www.thepaper.cn)記者表示,疫苗開發商此前基本上都是采用‘以變應變’的策略,在變異株出現後才匆忙研發針對該變異株的新疫苗,“這就永遠處于‘被動挨打’的局面。”。
姜世勃強調,采用“以不變應萬變”的策略研發廣譜抗冠疫苗的確是一個漫長而艱巨的任務,“但即使這次用不上,以後肯定是有用的。希望有關部門對這種戰略儲備性的研究要高度重視和支持。”
值得關注的是,BA.5已經在國內掀起波瀾。7月2日,西安出現新一輪疫情,3天之後,陝西省疾控中心經過全基因組測序後確定,本輪疫情毒株爲BA.5.2分支,這是中國大陸首次報告BA.5本土疫情。隨後,北京、遼甯、天津、上海等地均陸續檢測出BA.5毒株。而在此前的5月,國內從輸入病例中首次檢出BA.4和BA.5。
國家衛健委疾控局有關負責人表示,正密切關注有關國家BA.4和BA.5的流行趨勢,及時跟進全球關于新型變異株的研究進展,及時評估研判,指導各地落實好《新型冠狀病毒肺炎防控方案(第九版)》的要求,科學精准做好奧密克戎變異株疫情的防控工作。
BA.4/5:更具傳染性且更易造成抗體逃逸
新的變異株是否會取代當下的主流毒株,一旦成功“接班”,又將如何撼動既有的預防和治療策略?這是科學界、疫苗和藥物生産商以及各國政府在這兩年多的時間裏密切關注的問題。
BioNTech首席執行官兼聯合創始人Ugur Sahin博士此前即表示,“奧密克戎出現了新進化的亞系,在競爭中擊敗了BA.1,並表現出越來越大的免疫逃逸潛力的趨勢。因此,如果流行病學和實驗室數據給出了提示證據,我們將保持警惕,並准備根據新出現的亞系迅速調整我們的奧密克戎候選疫苗。”
“正如預期的那樣,病毒正在繼續進化,這些新的、更具傳染性的亞變異株在世界各地變得更加具有主導地位,這並不奇怪。”哥倫比亞大學瓦格洛斯學院的內科和外科醫生學院亞倫•戴蒙德艾滋病研究中心主任、中國工程院外籍院士何大一(David D. Ho)近日表示,“了解目前可用的疫苗和抗體治療方法如何應對新的亞變異株,對于制定預防嚴重疾病、住院和死亡的策略至關重要。”
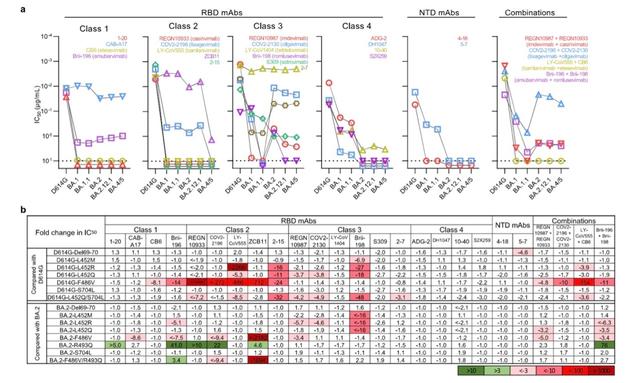
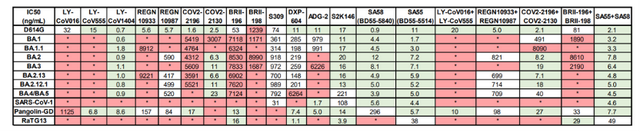
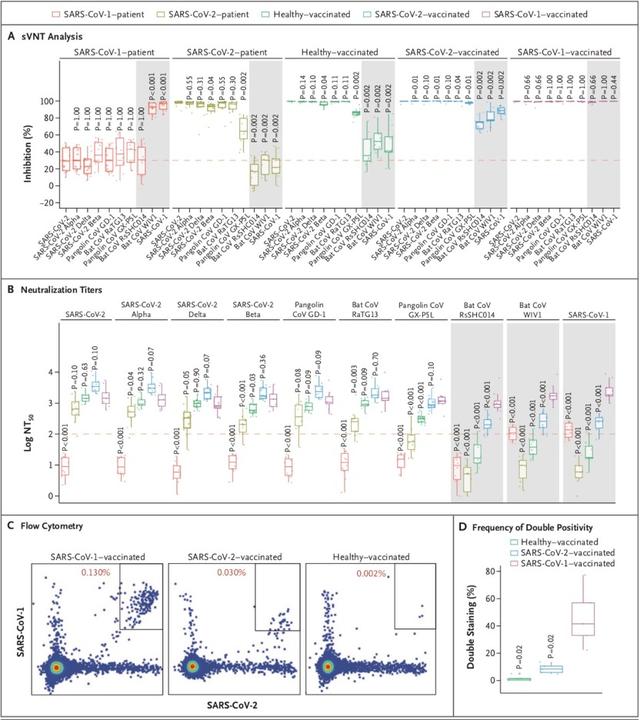
7月5日,何大一團隊在頂級學術期刊《自然》在線發表了一項研究,團隊研究了接受至少三劑mRNA疫苗,或兩次接種後感染奧密克戎的個體的抗體中和新的亞變異株的能力。他們得出,BA.2.12.1對接種疫苗及加強針的血清的抗性比BA.2高1.8倍,而BA.4/5的抗性大大提高至4.2倍,且因此更有可能導致突破性感染,即接種現有疫苗的情況下仍然被感染。此外,他們通過假病毒體外試驗評估得出,只有CAB-A17、COV2-2130、2-7和LY-COV1404這4種單抗對BA.2.12.1和BA.4/5仍保持良好的體外效價,其中只有LY-COV1404(bebtelovimab)已被授權用于臨床治療。
實際上,在更早之前的6月17日,謝曉亮等人在《自然》雜志發表的研究顯示,多數現存抗體藥物對奧密克戎中和活性大大下降。BA.2、BA.4和BA.5攜帶的S371F、D405N和R408S位點突變導致大部分β冠狀病毒廣譜抗體(如S309,即Sotrovimab)失活,仍然對BA.2.12.1和BA.4/BA.5保持中和活性的爲LY-CoV1404(Bebtelovimab)和COV2-2130(Cilgavimab)。
該研究最早于5月2日在線發布于bioRxiv預印本平台,是世界首篇系統性研究BA.2.12.1和BA.4/5刺突蛋白結構和體液免疫逃逸特性,揭示奧密克戎突變株“抗原原罪”或“免疫印迹”分子機制的研究論文,在國際學術界引起了廣泛關注。
這項研究還發現,接種三針疫苗人群的血漿對BA.2.12.1和 BA.4/5的中和能力相比BA.2有大幅下降,且BA.1突破感染的康複者血漿對BA.2.12.1和BA.4/5的中和能力也有明顯下降。流式細胞分析和單細胞VDJ測序結果說明,BA.1突破感染主要喚起人體內接種疫苗後産生的對原始株的體液免疫記憶,由此誘發的抗體可以同時中和原始株和BA.1,但對新變體的廣譜中和活性不佳,這符合“抗原原罪”或“免疫印迹”理論,提示基于BA.1的奧密克戎疫苗難以對新的突變體提供廣譜有效的預防能力,可能並不適合作爲現有人群免疫背景下的加強針。
而此前的6月22日,國際權威學術期刊《新英格蘭醫學雜志》(NEJM)刊登了來自哈佛大學Beth Israel Deaconess醫學中心的最新研究。這項研究也發現,接種了3針mRNA疫苗(BNT162b2)2周之後,受試者的中和抗體滴度對BA.4/5較新冠病毒原始毒株下降了21倍。同時,這一研究也顯示,BA.4和BA.5同樣能夠逃逸感染BA.1、BA.2所帶來的免疫。
從系統發育上來看,包括BA.4、BA.5在內的新的亞變異株獨立于BA.2進化。BA.4和BA.5的刺突蛋白是相同的,都有4個額外的突變,即Del69-70、L452R、F486V和R493Q。這些突變在刺突蛋白RBD(受體結構域)中的位置引起了人們的擔憂,即BA.4/5可能已經進化到可以進一步逃逸中和抗體。RBD是病毒刺突蛋白與感染細胞受體ACE2(血管緊張素轉化酶2)結合的區域,因此格外受到關注。
何大一等人指出,此前在Delta和Lambda變異中發現的L452殘基的M、R和Q替換,在很大程度上賦予了2類和3類RBD單抗(研究中將抗體分成4類)的抗性,其中L452R是更有害的突變。另外,F486V也可廣泛削弱幾種1類和2類RBD單抗的中和活性。但回複突變R493Q使BA.2對幾種1類和2類RBD單克隆抗體敏感,可被中和。他們的研究結果還表明,F486V突變降低了受體親和力,但R493Q回複突變提高了受體親和力。
研究團隊還構建了利用“加強針組”樣本繪制了一個可直觀顯示D614G、各種奧密克戎亞變體和個別點突變之間的抗原距離圖。該圖顯示,BA.4/5對接種疫苗和加強針的個體獲得的血清具有更強的中和抗性,其中一些突變導致抗體逃避。
何大一實驗室成員、上述論文的第一作者王茜對澎湃新聞(www.thepaper.cn)記者表示,新冠病毒是RNA病毒,容易突變。與最早期的野生型病毒相比,奧密克戎的各個突變株在刺突蛋白區域積累了超過30個突變。其中的部分突變可以幫助病毒實現免疫逃逸。
“我們的研究表明,BA.4/5與BA.1以及BA.2相比,對疫苗加強針接種者的血清中和活性降低了4倍左右。BA.4/5在人群中的傳播率、對保護性抗體的逃逸、以及潛在的進一步突變,都值得我們擔憂。”她指出,尤其是現在有研究初步表明BA.5相對于BA.2更具致病性,需要進行持續的關注和研究。
不過,截至目前,關于BA.4/5的致病性研究相對較少。總體而言,相比BA .1、BA.2主要感染上呼吸道,目前的初步研究顯示,BA.4、BA.5更能走肺,其在人肺泡上皮細胞中複制能力更強。
此前來自東京大學、京都大學、北海道大學、九州大學、神戶大學、以色列魏茨曼科學研究所等27家科研單位在醫學預印本網站bioRxiv上聯合發表研究,顯示在人類肺泡上皮細胞中的複制效率高于BA.2,特別是BA.4、BA.5比BA.2在肺泡上皮細胞中有著更強的細胞融合能力。
爲了測試奧密克戎諸多變異毒株在人肺泡上皮細胞中的複制能力,研究團隊通過反向遺傳學准備了嵌合重組帶有L452R突變的SARS-CoV-2病毒,實驗顯示BA.4、BA.5對人肺泡上皮細胞感染形成的斑塊大于BA.2感染形成的斑塊。研究者通過實驗還發現,BA.4、BA.5在人類iPSC衍生的肺泡上皮細胞中複制能力比BA.2高效得多。
世衛組織在7月6日發布的疫情周報中則強調,目前還沒有證據表明BA.4、BA.5或BA.2.12.1的嚴重程度與BA.2相比有任何變化。但是,BA.2.12.1、BA.4和BA.5的流行率上升與世衛組織若幹區域的病例增加相吻合。在一些國家,病例的增加還導致住院、ICU入院和死亡人數激增。
而來自南非的研究團隊6月28日在預印本平台medRxiv發布了一項針對Omicron BA.4/5感染者病情嚴重程度的文章。該團隊認爲,真實世界中,南非實驗室確診的奧密克戎BA.4/5病例的病死比例1.9%;與BA.1病例相比,BA.4/5病例發生病死或危重症的風險無差別,均低于更早的毒株。研究同時指出,疫苗接種仍能有效預防BA.4/5感染後發生危重症或病死,3劑疫苗接種的有效性爲73%。
不過,也有觀點認爲,南非暴發了多輪大規模的新冠感染,多個關切變異株均首先在南非檢測到,該地區人群的免疫系統對BA.4/5的抵抗力或值得探討。
王茜強調,接種現有的COVID-19疫苗,特別是接種加強針,對預防BA.4/5的感染依舊有效,並仍可降低BA.4/5感染導致的重症率。
謝曉亮提到,“BA.4/5與之前大家熟悉的BA.1和BA.2相比,在傳播上會有一定優勢,但在我國目前動態清零的防控政策下,仍可以得到有效控制。此外,三針滅活疫苗對奧密克戎各亞型的防感染作用雖然顯著降低,但仍能有效降低住院和死亡率。”
疫苗生産商緊急應對,能趕上今年秋冬季嗎?
眼下熱議的一個問題是,是否需要加緊推出新的疫苗來應對秋冬季?新的疫苗其成分該如何選擇?基于BA.1的候選疫苗是否已經“過時”?
“根據我們對BA.1康複者血漿的測試可以推測,基于BA.1的疫苗大概率對BA.4/5的效果不會很好。”謝曉亮表示,國外也已經推出了原始株和BA.1組合的多價mRNA疫苗,其對BA.4/5等新毒株的有效性也大幅下降,具體效果還需要臨床數據驗證。
“而加入BA.4/5的二價疫苗雖然會對目前的毒株效果可能更好,但不能排除在臨床試驗過程中被未來的新毒株快速逃逸。”他補充道。
美國食品藥品監督管理局(FDA)疫苗及相關生物制品咨詢委員會6月28日舉行了一場會議,公開討論了2022年秋冬季節是否有必要改變目前的COVID-19疫苗的疫苗株組成,以作加強針。
FDA生物制劑評價與研究中心(CBER)主任Peter Marks博士表示,咨詢委員會以壓倒性投票贊成在COVID-19疫苗中加入一種SARS-CoV-2奧密克戎成分,從2022年秋季開始在美國用于加強針。會議建議COVID-19疫苗制造商,在當前的疫苗成分中添加奧密克戎BA.4/5刺突蛋白成分,制造一種雙成分(二價)加強針疫苗,這些疫苗可能在2022年秋初至秋中開始使用。
值得一提的是,FDA在批准授權時,將不會要求公司提交針對BA.4/5的新的人體臨床試驗數據,而是將依賴于針對早期奧密克戎變異株BA.1的有效性研究。Marks稱,這與處理流感毒株變化的方法非常相似,會有一些氨基酸差異,但預計在安全性方面不會有任何差異。“我們很樂意這樣做,因爲這將幫助我們走在事情的前面。”
實際上,在奧密克戎早期毒株出現時,各家疫苗研發和生産商已經開始著手准備更適應的疫苗。莫德納在6月22日宣布了二價(奧密克戎BA.1) COVID-19加強針候選疫苗mRNA-1273.214的新臨床數據。在先前已接種疫苗和接種加強針的參與者中,接種一個月後,50μg mRNA-1273.214加強針劑量在所有參與者中引發了對奧密克戎亞型BA.4和BA.5的有效中和抗體反應,無論之前是否感染。
不過,相較于BA.1,針對BA.4/5的中和效價大約降低了3倍。基于所有的數據,莫德納稱正努力在未來幾周內完成監管申報,要求將加強針疫苗的成分更新爲mRNA-1273.214。
莫德納的首席執行官Stéphane Bancel還表示,准備從8月開始供應下一代二價加強針,“趕在秋季初因奧密克戎亞變體導致SARS-CoV-2感染可能上升之前。”
莫德納方面最新的消息則是,7月11日,該公司在披露mRNA-1273.214加強針的最新臨床數據之外,正式宣布推進另一種針對BA.4/5的二價候選疫苗mRNA-1273.222。莫德納稱,與目前授權的加強針相比,mRNA-1273.214二價加強針是在秋季加強針接種季之前在臨床試驗中對BA.4/5株顯示顯著更高滴度的候選疫苗。而mRNA 1273.222是基于BA.4/5株,並且正在按照FDA最近的建議進行開發。
至于輝瑞公司和BioNTech方面,此前的6月25日,兩家公司公布了相關數據,評估了兩種奧密克戎適應性COVID-19候選疫苗的安全性、耐受性和免疫原性:一種是單價疫苗,另一種是二價疫苗,即由輝瑞-BioNTech COVID-19疫苗和奧密克戎BA.1的S蛋白的候選疫苗組合而成。2/3期臨床試驗的數據發現,與兩家公司目前的COVID-19疫苗相比,兩種候選奧密克戎疫苗的加強針對BA.1的免疫應答顯著更高。
類似的,他們在一項對56歲及以上參與者血清進行的SARS-CoV-2活病毒中和試驗中,兩種奧密克戎適應性的候選疫苗都能中和BA.4和BA.5,但其中和程度低于BA.1,滴度約比BA.1低3倍。輝瑞和BioNTech稱,在未來的幾周內將繼續收集更多關于BA.4/BA.5的研究數據。
而早在今年1月啓動基于奧密克戎BA.1的COVID-19疫苗研究時,BioNTech首席執行官及聯合創始人Ugur Sahin教授就表示,“疫苗繼續能對奧密克戎引起的嚴重疾病提供強有力的保護。然而,新的數據表明,疫苗誘導的對感染和輕度至中度疾病的保護衰退比之前的毒株觀察到的更快。”針對最新的BA.4/5, Sahin同樣持謹慎態度,以評估是否需要迅速調整候選疫苗。
6月29日,輝瑞公司和BioNTech還宣布了與美國政府達成一項新的疫苗供應協議。根據協議,美國政府將獲得1.05億劑新冠疫苗(30µg、10µg、3µg),將向兩家公司支付32億美元。這其中即可能包括奧密克戎修改版的成人COVID-19疫苗,當然前提是獲得FDA的授權批准。這些疫苗計劃最早于2022年夏末交付,並將持續到今年第四季度。
值得一提的是,輝瑞公司和BioNTech也已對外披露,他們還在開發針對BA.4/5變異株的特異性加強針,但目前仍處于早期測試階段。
然而,需要考慮的一點是,如果轉爲針對BA.4/5變異株的疫苗,或許會推遲這些疫苗投入市場的時間。比如,輝瑞公司和BioNTech此前就提到,兩家公司實際上已經開始生産奧密克戎適應性候選疫苗,以便在獲得授權或批准後,迅速開始交付。
就國內來看,國藥集團中國生物北京生物制品研究所、武漢生物制品研究所研發的BIBP-新型冠狀病毒滅活疫苗(奧密克戎變異株)、WIBP-新型冠狀病毒滅活疫苗(奧密克戎變異株)兩款疫苗,以及科興控股生物技術有限公司研發的克爾來福-奧密克戎株新型冠狀病毒滅活疫苗均在臨床試驗階段。
而智飛生物方面此前也透露,中科院微生物所與該公司正在推進該針對奧密克戎變異株的新一代重組蛋白新冠疫苗的研發,預計在7月份進行臨床申報。而高福等人在上述的最新文章中還提出另一種方案,接種重組蛋白疫苗ZF2001,並且將第二針與第三針的接種間隔延長到4-6個月,能使接種者對BA.4/BA.5的中和抗體水平相對更高。他們認爲,這一接種策略可能有助于國內目前應對BA.5在內的突變株。
另外,康希諾生物針對包括奧密克戎在內的變異株的新型冠狀病毒mRNA疫苗也于2022年4月獲得國家藥品監督管理局核准簽發的《藥物臨床試驗批件》,目前已啓動I期臨床試驗。
魏文勝對澎湃新聞記者表示,“BA.4/5免疫逃逸的確非常厲害,我們也看到了這個很重要的特點,所以我們也在開發不同方案的疫苗,來應對快速變異的毒株。”他提到,圓因生物也在加緊IND申報。
王茜對澎湃新聞記者表示,目前的COVID-19疫苗以早期野生型刺突蛋白爲靶標,旨在誘導保護性抗體。“雖然疫苗對現有的各種突變株都具有一定的保護效果,但是效價卻有所降低。對于未來的疫苗設計,以野生型及奧密克戎刺突蛋白爲靶標的雙價疫苗是一種選擇,可以誘導具有交叉保護活性的抗體。”
廣譜方案,能否扭轉“被動挨打”局面?
接受澎湃新聞(www.thepaper.cn)記者采訪的多位專家和疫苗、抗體的開發人員均提到一個關鍵詞——廣譜。
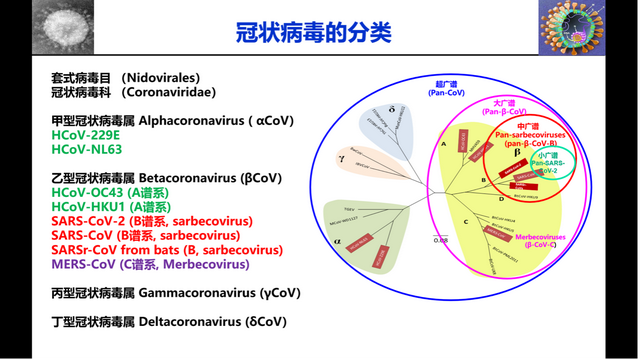
姜世勃提到,當下COVID-19大流行下,廣譜抗冠疫苗和藥物可歸爲四類:第一類爲“小廣譜”,即針對SARS-CoV-2及其變異株(包括奧密克戎BA.4/5);第二類爲“中廣譜”,針對β冠狀病毒B譜系,即除了SARS-CoV-2及其變異株,還包括SARS-CoV-1及其變異株和來自蝙蝠的SARS相關病毒(SARSr-CoV)等;第三類爲“大廣譜”,即包括整個β冠狀病毒,在第二類的基礎上,還囊括了MERS-CoV等;第四類則爲“超廣譜”,即所有可感染人的冠狀病毒(HCoVs)。
“現在很多研發團隊和公司都在做‘小廣譜’疫苗,但迄今爲止還沒有成功的例子。”姜世勃表示,“等變異株出現後利用研發第一代新冠疫苗的技術平台,采用‘以變應變’的策略,可以快速地研發出針對變異株的新疫苗。但缺點是在新疫苗上市之前,又一個新的變異株開始流行了,造成疫苗研發的速度永遠趕不上病毒變異的速度。”
他同時再次強調,采用“以不變應萬變”的策略,是在毫無成功先例的條件下開展原創性的研究,的確具有很高的難度和較慢的速度。“但希望有關部門一定要重視起來,盡早地支持相關的研究,盡快地研發出未來可用的‘大廣譜’疫苗和藥物,防控未來的新冠病毒變異株(如BA.6、BA.7等),甚至新變種(如SARS-CoV-3)的流行。”
他舉例提到,目前在中東地區,已有患者同時感染奧密克戎和MERS-CoV,“如果這兩個病毒在免疫缺陷(如艾滋病)患者體內發生了重組,産生的新變種(如SARS-CoV-3)可能具有SARS-CoV-2那樣的高傳播力和MERS-CoV那樣的高致死率,那將會導致另一場人類的災難。”
王茜也表示,新冠病毒還在持續變異中,且自然界中的其他非典及新冠類似的病毒仍然具有潛在感染人類的可能。“以這些病毒的保守區域表位作爲靶點,設計廣譜疫苗具有很高的前景。”
就此問題,謝曉亮也談到,“一種策略是技術成熟的前提下,在政策層面加速疫苗更新換代,類似每年更新的流感疫苗。另一種更‘一勞永逸’的策略是通過人工設計抗原來制造不易被突變逃逸的、特異性激活強中和廣譜抗體的β冠狀病毒通用疫苗,以更好地應對新冠突變株和未來可能會感染人類的冠狀病毒。”
對于後者,謝曉亮補充道,該思路難度很大,“需要我們對抗原的免疫原性非常了解,但這方面的基礎科研目前還存在較大空白,我們通過對大量中和抗體的研究已經對抗原有了初步了解,成功的新冠通用疫苗問世還需等待較長的時間。”
實際上,早在2021年10月,杜克—新加坡國立大學醫學院教授王林發等人發表在《新英格蘭醫學雜志》的一項研究即證明,爲SARS-CoV-1感染的幸存者接種BNT162b2 mRNA疫苗後,誘導産生了有效的跨進化枝β冠狀病毒B譜系中和抗體。這些抗體水平高且廣譜,不僅可中和已知的關切變異株,而且可中和在蝙蝠和穿山甲中發現的、且有可能導致人類感染的β冠狀病毒B譜系病毒。
王林發等人認爲,他們的觀察結果表明了β冠狀病毒B譜系疫苗策略的可行性。
而對于另一防疫工具中和抗體,“廣譜”也是重要的方案。
謝曉亮表示,目前國外大部分批准使用的抗體藥物相繼被奧密克戎逃逸,而國內目前用于治療的中和抗體也沒有一個能對BA.4/5等新毒株保持足夠中和活性的。“爲了盡量避免這種逃逸現象,我們需要在實驗室篩選出針對β冠狀病毒B譜系的廣譜中和抗體。這類抗體結合在抗原不易突變的位點上,並對現有所有新冠病毒突變株和多數相關的β冠狀病毒都有強效中和能力,更難被逃逸。”
據悉,其實驗室和合作團隊目前也已經篩選出大批這樣的高活性廣譜β冠狀病毒B譜系中和抗體並選定了候選藥物,正在准備進行臨床研究。
謝曉亮等人的上述研究顯示,他們篩選出了一對表位不沖突的廣譜中和抗體組合SA58和SA55,該抗體對能高效中和包括奧密克戎株新亞型在內所有流行過的突變株,以及非典病毒、RaTG13、Pangolin-GD等β冠狀病毒B譜系病毒。研究團隊認爲,這有望成爲對目前流行株和將來可能出現的突變株兼具強效預防和治療效果的藥物。
對于上述SA58和SA55的篩選,謝曉亮認爲其團隊優勢在于高通量酵母展示深度突變掃描技術(DMS)。在新冠病毒入侵過程中,受體結合域(RBD)因與人體細胞膜的ACE2受體結合而發揮著關鍵作用。“RBD主要由201個氨基酸組成,我們通過PCR將這201個位點的每一個氨基酸都突變成其他19種,總共得到了近4000種RBD突變,將帶有這4000種不同氨基酸突變的RBD蛋白分別展示到酵母細胞表面,通過篩選逃逸中和抗體結合的酵母細胞,測定這些細胞展示的RBD蛋白帶有的突變氨基酸,可以得到每種中和抗體的突變逃逸位點。”
最終,研究團隊通過分析1640種抗體(包括從接種過新冠疫苗的非典康複者血液中篩出的中和抗體)的突變逃逸位點,篩選出廣譜中和抗體組合SA58和SA55。初步實驗也證明,SA55和SA58 將很難被以後的新冠變異株逃逸。
謝曉亮反複強調,“找到高活性的中和抗體不難,難就難在找到不會很容易被逃逸的中和抗體。”
騰盛博藥高級副總裁、生物制藥部門負責人朱青博士在過去的很多年裏做的即是抗病毒的廣譜抗體的研發。對于此次疫情下討論的中和抗體,她認爲,“需要花很多時間和精力去尋找血樣來源,挑戰是有,但並不是做不到。”朱青在接受澎湃新聞(www.thepaper.cn)采訪時談到,“比如說,我們現在做的很多抗體都是從感染了新冠病毒的患者血液當中去篩選B細胞、尋找抗體。研發廣譜抗體的話,就需要去找感染了類似于新冠病毒的別的病毒家族的患者,這樣就會有很大的機會找到廣譜的抗體。”
朱青等人所在的騰盛華創(由騰盛博藥、清華大學和深圳市第三人民醫院共同成立)團隊、清華大學醫學院張林琦教授團隊、清華大學生命學院王新泉教授團隊與深圳市第三人民醫院張政教授團隊此前研發的新冠中和抗體藥物——安巴韋單抗(BRII-196)/羅米司韋單抗(BRII-198)于2021年12月被中國藥監局批准上市,7月7日在國內正式商業化上市。
朱青同時談到,針對奧密克戎第二代變種的藥物研發,“我們目前還在繼續關注一些廣譜的抗體,這些研究目前都在合作中。”
值得注意的是,無論是何大一團隊的數據還是謝曉亮等人的試驗均顯示,對BA.4/5仍保持良好體外效價的單抗中並不包括安巴韋單抗/羅米司韋。
在病毒持續變異的過程中,現有的療法實際上也處于同步的動態評估中。
以葛蘭素史克(GSK.L)和Vir Biotechnology開發的靜脈注射單克隆抗體藥物sotrovimab爲例,FDA在今年的4月5日即宣布,由于奧密克戎BA.2亞型變異株引起的COVID-19病例比例超過50%,而數據顯示sotrovimab的授權劑量不太可能對BA.2亞型有效,因此Sotrovimab不再在美國範圍內獲得授權。“醫療服務提供者在爲確診患者選擇合適的治療方案時,應該使用其他經批准或授權的産品。”FDA當時補充稱,將繼續在美國所有地區監測BA.2,並在適當的時候提供後續溝通。
責任編輯:李躍群
校對:丁曉