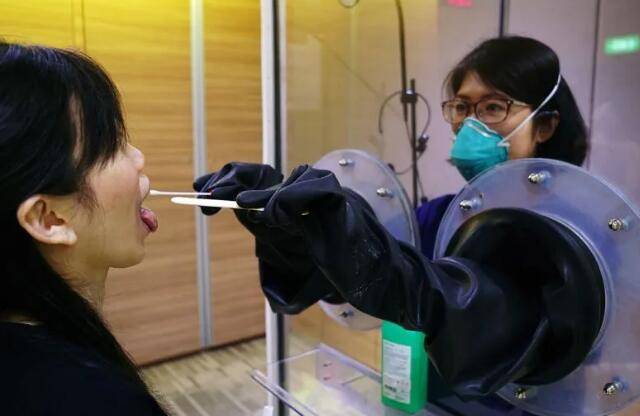
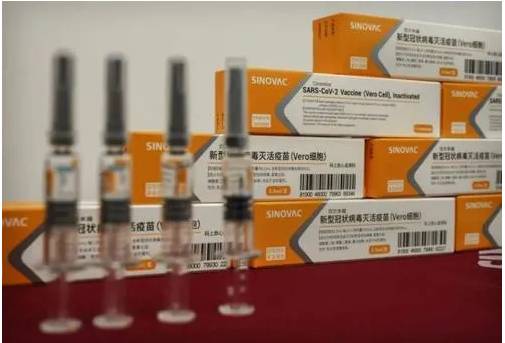
未通過中國疫苗的真正原因
新加坡目前已經獲批使用的冠病疫苗是輝瑞(Pfizer)—BioNTech和莫德納(Moderna)兩款冠病疫苗。中國的科興疫苗也已經送抵新加坡,但是它遲遲還沒有獲得批准。
新加坡衛生科學局稱,不能因爲疫苗已經到貨了,就在審批流程上走捷徑。
據悉,冠病疫苗必須經過衛生科學局設下的六層評估關卡和三輪專家評估,滿足了重重嚴格的要求,才被獲准供本地使用接種。
衛生科學局的工作早在去年7月就已經開始。當新加坡政府同輝瑞、莫德納,以及科興生物簽訂冠病疫苗的預購協議後,便主動同這三家藥劑公司聯系,要求他們提交數據。
當時,團隊主要收集的是關于疫苗技術的最新信息,三家公司在研發和測試的同時,也須陸續提交滾動式數據,衛生科學局一收到數據便會立刻評估。
(圖:來源自網絡)
科興疫苗到現在還沒有獲批,很大的原因是它們提交的信息還不足。
根據科興疫苗第三期臨床研究數據顯示,巴西有逾1.2萬名18歲或以上醫務人員接受測試,相隔14天接種兩劑疫苗的保護效力爲50.65%,對住院、重症及死亡病例的保護效力100%。
該疫苗在土耳其的試驗數據顯示,共有7371名醫護人員或一般民衆接受測試,其中1322名受測者完成兩劑接種並進入第二劑接種後14天的觀察期,該疫苗預防病毒的保護效力爲91.25%。
盡管已經有巴西和土耳其等地的臨床研究數據,但測試的結果仍不完善,因此新加坡仍然需要科興提供更新更完整的資料才能評估。
(圖:來源自網絡)
新加坡根據疫苗研發的各個階段,設下六道嚴格評估關卡。首先是檢查疫苗的化學配方(chemical formulation),看看是否存有雜質;第二道關卡是評估疫苗在動物的測試。
接下來必須跨過的三道關卡,則是疫苗的三期臨床測試。
第一期是對約300名對象進行不同劑量的測試,確保疫苗的安全性。第二期臨床測試是研究疫苗的治療效果。第三期測試,則是讓大規模對象進行疫苗和安慰劑的對照試驗,以測試藥物的治療效果,以及是否比那些只注射安慰劑的人,産生了更多的不良反應。
通過了這五道關卡後,生産商也須滿足第六項要求:證明有良好生産規範,能安全且大規模地生産疫苗,才能獲得評估。
疫苗完成評估後,還須進行三輪的專家審批,通關要求比一般疫苗和藥物來得更爲嚴謹。
通過新加坡保健服務集團副總裁馮國榮教授領導的衛生科學局11人藥物咨詢委員會的審查後,衛生科學局接著安排國家傳染病中心主任梁玉心教授在內的四名傳染病專家進行評估,之後還須通過衛生部14人冠病疫苗專家團的鑒定。
衛生科學局表示,選疫苗不能只看疫苗的效能,即便效能較低,但在物流運輸方面能更順暢,如果大多數人都能接種,無需高效能的疫苗就達到群體免疫。
(圖:來源自網絡)
新馬邊境將逐步放開
新加坡將繼續同馬來西亞合作逐步開放兩國邊境,讓兩國居民跨境流動。
不過,新加坡外交部長維文在國會撥款委員會辯論部門開支預算時說,這需要涵蓋雙方都認同的公共衛生協議,以保障人民的健康和安全。于此同時,雙方也將把兩國所具備的醫藥資源因素考慮在內。
維文說,在2019冠狀病毒疫情期間,新加坡與馬國緊密合作,協助超過350名年長、年幼或弱勢的國人與身在新加坡的家人團聚。兩國也在疫情期間合作,減低疫情對兩國企業、工人和國民,包括跨境貨物流通造成的影響。
由于疫情的關系,新加坡在2月1日暫停與馬國的互惠綠色通道的安排達3個月。新加坡將在期限屆滿後檢討有關措施。
(圖:來源自網絡)