編者按:疫情爆發已過去兩年,全球各個國家都受到巨大沖擊,如今雖逐步放開防疫措施,仍然反複的疫情給人們安穩生活帶來的影響似乎無休止,而新冠究竟爲什麽生命力如此”頑強“,從醫學的角度一起來看看。
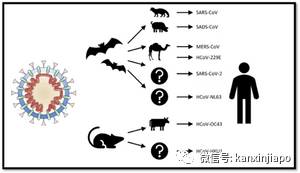
兩年來無情的新冠肺炎病毒(SARS-CoV-2) 不分國界,不分人種,不分宗教與信仰,惡劣的突擊人類社會,將疫情在全世界蔓延對人類造成了嚴重的傷害。無論對公共衛生,人的身心健康,生命安全,都起了嚴重的危害。新冠肺炎疫情也影響了世界經濟的操作,緩慢經濟發展,疫情的猛擊加上美國主導的貿易戰,致使全世界國際秩序,經濟規則的混亂。當前新冠肺炎疫情惡劣的程度,是近年代來全球瘟疫史上最嚴重的一次。新冠肺炎病毒在世界一波末停,另一波又起的不斷擴散。隨著病毒不停的産生變種,新冠肺炎病毒的感染力及其對人體致病的迅速也是越來越惡劣,這對預防醫學,治療疾病,及疫苗研制工作者都是一個極大的挑戰。新冠疫情也嚴重的增加對社會各行業的壓力及經濟的負擔。經濟上比較薄弱的國家,在這無情疫情的沖擊下,無從應對,只好讓病毒在沒有約束的情況下繼續延蔓。病毒能更加迅速的感染人類,産生更多的突變。病毒以新突變的形態,不僅能在本土繼續的擴散,也能倒流回到前富有國度,卷土重來。突變了又再突變的病毒對全人類似乎是永無止境的威脅。A:人畜共患的冠狀病毒 Zoonotic Coronavirus由冠狀病毒基因核酸的排列與組合,可以推斷,冠狀病毒存在于世間,已有8000到一萬年的曆史,這是一個漫長的曆史過程,在這時期人類受到該病毒傷害的程度不得而知,只是到了近代,隨著生物科學技術的發展,在60年代科學家發現了細胞培養(Tissue Culture technique)技術,利用細胞培養技術能有効的生産多種病毒疫苗。同時細胞培養技術也可以用來分離感染人類的病毒和檢測病毒的特性。第一種感染人類造成呼吸器官疾病的冠狀病毒,HCoV-229E便是在1962年用細胞培養技術(kidney tissue culture)分離出來的。隨著細胞培養技術的發展,體外培養呼吸器官的技術(Human embryonic Tracheal Organ Culture Technique, OC)也成功的建立了。應用OC技術,另一人畜共患病毒,HCoV -OC43也被分離了出來。接著下來,其他普通感冒性的冠狀病毒,也接二連三的被發現了。經過不斷的探索有關冠狀病毒最初的來源,發現到能感染人類的大部分人畜共患病毒是來自蝙蝠,也有一些冠狀病毒其最初的寄主是鼠類。這些病毒很可能經過了基因的突變,再經過1或2種不同動物的寄主才轉移到人類,主要感染人類呼吸器官或腸道及其他器官,對人類造成不同程度的傷害。目前已知能夠感染人類的人畜共患病毒有七種: 圖片1: 源自wikipedia.org/ coronavirus.其中五種病毒的原始寄主是蝙蝠,另外兩種病毒的原始寄主是鼠類。人們根據它們感染人類時被發現的年代,原始寄主是蝙蝠的冠狀病毒分別如下:HCo…V-229E, (1962),SARS-CoV-1 (2002),HCoV-NL63 (2004),MERS-CoV (2012),SARS-CoV-2 (2019).原始寄主是鼠的是 ,HCoV-OC43 (1967),HCoV-HKU1 (2005).七種人畜共患的冠狀病毒中,比較惡劣傷害人類的冠狀病毒多數是來自蝙蝠。蝙蝠是飛行哺乳動物,體內除了與其共生存的冠狀病毒外,也有其他不同種類非冠狀病毒與其共生。這些寄生于蝙蝠體內的各種病毒,都適應了蝙蝠體內的環境,不會傷害蝙蝠,對蝙蝠來說,這些病毒都是良性的。
圖片1: 源自wikipedia.org/ coronavirus.其中五種病毒的原始寄主是蝙蝠,另外兩種病毒的原始寄主是鼠類。人們根據它們感染人類時被發現的年代,原始寄主是蝙蝠的冠狀病毒分別如下:HCo…V-229E, (1962),SARS-CoV-1 (2002),HCoV-NL63 (2004),MERS-CoV (2012),SARS-CoV-2 (2019).原始寄主是鼠的是 ,HCoV-OC43 (1967),HCoV-HKU1 (2005).七種人畜共患的冠狀病毒中,比較惡劣傷害人類的冠狀病毒多數是來自蝙蝠。蝙蝠是飛行哺乳動物,體內除了與其共生存的冠狀病毒外,也有其他不同種類非冠狀病毒與其共生。這些寄生于蝙蝠體內的各種病毒,都適應了蝙蝠體內的環境,不會傷害蝙蝠,對蝙蝠來說,這些病毒都是良性的。 圖片2:網絡圖片蝙蝠平常除了睡眠之外,每天都會有飛行的習慣。蝙蝠飛行時,體內溫度升高,平時可以達到攝氏41度以上。體溫的升高,對蝙蝠的生存是很有利的。蝙蝠是通過體內的高溫,來清理和淘汰許多耐不了高溫的的病菌與病毒。原始寄主是蝙蝠後又轉移感染人類的五種冠狀病毒,其實是自然的、經過蝙蝠高體溫的選擇而生存下來的病毒。冠狀病毒由蝙蝠高體溫的環境跳越到人體,人體的溫度是攝氏37度,比較上,人的體溫是更適合病毒的繁殖與生長(注:在實驗室裏,冠狀病毒在攝氏37度的溫箱裏生長的特別快)。那些能長期寄生在高體溫蝙蝠體內的病毒可能是已經失去了毒性,或者在長期被高溫壓制下,病毒也不容易發揮毒性。當有機會跳到人體內,病毒似乎是得到了解放,能在沒有高溫約束的環境裏發揮其毒性,産生凶猛的病變。
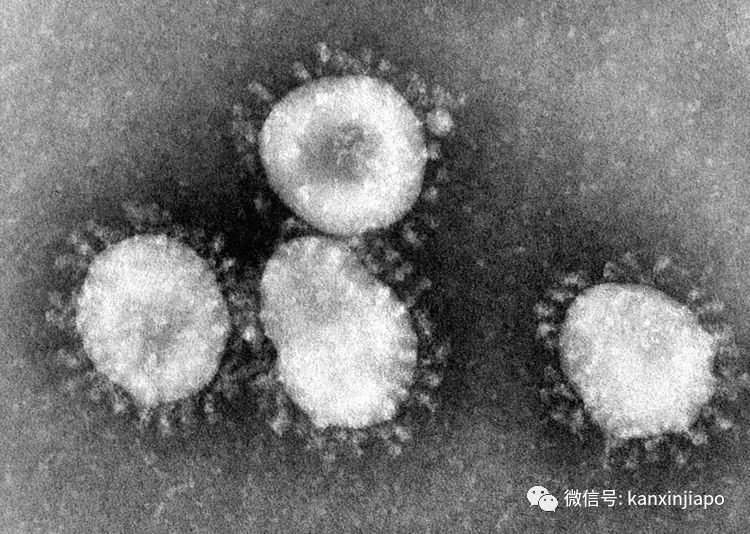
圖片2:網絡圖片蝙蝠平常除了睡眠之外,每天都會有飛行的習慣。蝙蝠飛行時,體內溫度升高,平時可以達到攝氏41度以上。體溫的升高,對蝙蝠的生存是很有利的。蝙蝠是通過體內的高溫,來清理和淘汰許多耐不了高溫的的病菌與病毒。原始寄主是蝙蝠後又轉移感染人類的五種冠狀病毒,其實是自然的、經過蝙蝠高體溫的選擇而生存下來的病毒。冠狀病毒由蝙蝠高體溫的環境跳越到人體,人體的溫度是攝氏37度,比較上,人的體溫是更適合病毒的繁殖與生長(注:在實驗室裏,冠狀病毒在攝氏37度的溫箱裏生長的特別快)。那些能長期寄生在高體溫蝙蝠體內的病毒可能是已經失去了毒性,或者在長期被高溫壓制下,病毒也不容易發揮毒性。當有機會跳到人體內,病毒似乎是得到了解放,能在沒有高溫約束的環境裏發揮其毒性,産生凶猛的病變。 圖片3:電子顯微鏡下的冠狀病毒,病毒顆粒爲90-120 nm。圖片源自wiki/coronavirus七種冠狀病毒中,其中四種病毒;Corona 229 E, HCoV NL 63, HCoV-OC43,HCoV-HKU1,對人體的傷害程度是比較溫和的,它們感染人的上呼吸器官(鼻,咽,喉,圖片4)只引起輕微的普通感冒病症,只是少許的發燒,流鼻涕和打噴嚏。只在很少的情況下,才會延續到下呼吸器官感染。
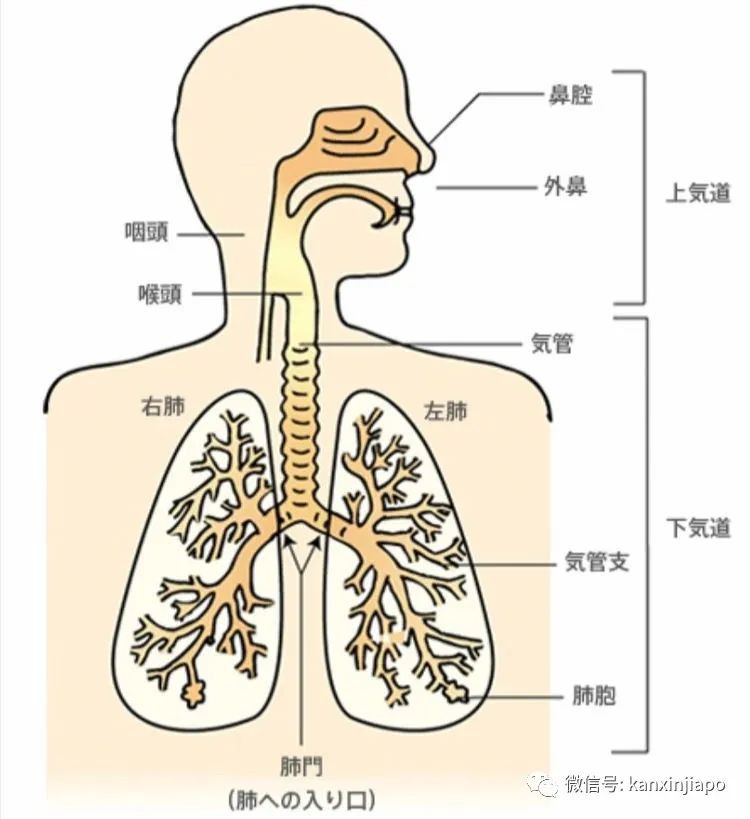
圖片3:電子顯微鏡下的冠狀病毒,病毒顆粒爲90-120 nm。圖片源自wiki/coronavirus七種冠狀病毒中,其中四種病毒;Corona 229 E, HCoV NL 63, HCoV-OC43,HCoV-HKU1,對人體的傷害程度是比較溫和的,它們感染人的上呼吸器官(鼻,咽,喉,圖片4)只引起輕微的普通感冒病症,只是少許的發燒,流鼻涕和打噴嚏。只在很少的情況下,才會延續到下呼吸器官感染。 圖片4,網絡圖片:人的呼吸系統分爲上呼吸道與下呼吸道:感染人類的七種冠狀病毒中,其中四種比較溫和的是以感染人上呼吸器官爲主。另外三種比較惡劣的病毒則會感染下呼吸道,造成嚴重的肺炎甚至死亡。其余三種源自于蝙蝙的冠狀病毒是比較惡性的;它們是2003年的SARS-1, 2012-13年的MERS,及目前已經蔓延近兩年,還繼續在突變,感染人類的新冠肺炎病毒SARS-2 (COVID-19病毒)。SARS-1及MERS兩種冠狀病毒對人的殺傷力度很強;SARS-1的死亡率是14% (WHO統計), MERS的死亡率是32.7%,但是它們的感染力相對上是比較弱的,只蔓延到數個國家,成不了國際流行性的大傳染病(not a global pandemic)。新冠肺炎病毒COVID-19的感染力就有很大的不同;目前已傳播到全世界180個國家,超過兩億的世界人口中了感染,超過420萬人死亡。受到COVID-19病毒的感染人數及造成死亡的人數目還是在繼續的增長中。在所有七種冠狀病毒中只有SARS-2新冠肺炎病毒造成全球性的大傳染病。B:新冠肺炎病毒 COVID-19 (SARS-CoV-2 virus)
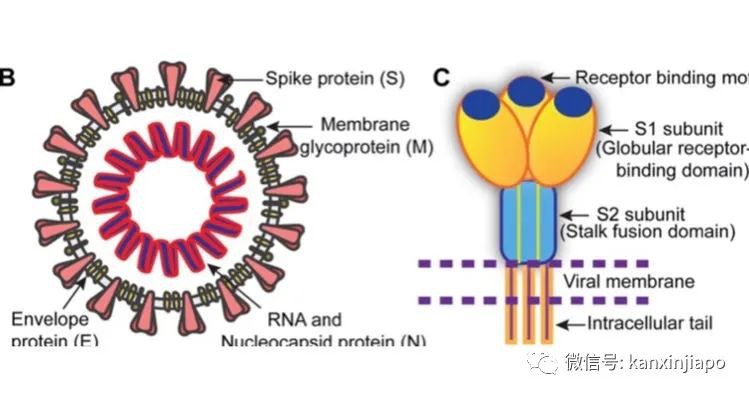
圖片4,網絡圖片:人的呼吸系統分爲上呼吸道與下呼吸道:感染人類的七種冠狀病毒中,其中四種比較溫和的是以感染人上呼吸器官爲主。另外三種比較惡劣的病毒則會感染下呼吸道,造成嚴重的肺炎甚至死亡。其余三種源自于蝙蝙的冠狀病毒是比較惡性的;它們是2003年的SARS-1, 2012-13年的MERS,及目前已經蔓延近兩年,還繼續在突變,感染人類的新冠肺炎病毒SARS-2 (COVID-19病毒)。SARS-1及MERS兩種冠狀病毒對人的殺傷力度很強;SARS-1的死亡率是14% (WHO統計), MERS的死亡率是32.7%,但是它們的感染力相對上是比較弱的,只蔓延到數個國家,成不了國際流行性的大傳染病(not a global pandemic)。新冠肺炎病毒COVID-19的感染力就有很大的不同;目前已傳播到全世界180個國家,超過兩億的世界人口中了感染,超過420萬人死亡。受到COVID-19病毒的感染人數及造成死亡的人數目還是在繼續的增長中。在所有七種冠狀病毒中只有SARS-2新冠肺炎病毒造成全球性的大傳染病。B:新冠肺炎病毒 COVID-19 (SARS-CoV-2 virus) 圖片5:冠狀病毒的結構是由RNA, S蛋白,N蛋白,E蛋白及M蛋白組成(左)。S蛋白(右)是由三蛋白聚體(trimer)組成. Trimer上端(黑點)是病毒與人接受體(ACE-2)結合時最主要的區域RBM。源自 NCBI網絡。新冠肺炎病毒是屬于RNA病毒;在所有的RNA病毒中,新冠肺炎病毒的基因是最大的,它是由三萬個核酸組成一單線、正性的RNA基因( Consists of 30,000 Nucleotides )。病毒的RNA是與病毒的核蛋白(N蛋白質)組合成螺旋式的核衣殼(Helical Nucleocapsid) (圖片5左)。核衣殼是處在病毒被膜(Envelope)的中心。病毒的被膜是由病毒的三種結構性蛋白質;M蛋白質,S蛋白質及E蛋白質聯合組成(圖片5,左)。在所有病毒結構性的蛋白質中(S, N, M, E. ), S蛋白質( Spike protein)扮演重要的角色,病毒是通過它的S蛋白質來啓動對人的感染。S蛋白質突露在病毒外膜,形成冠狀的突出蛋白體。當病毒開始感染人時,人體內的蛋白分解酵素(FURIN Enzyme)即會將病毒的S蛋白切開成S1及S2兩段。S1中的氨基酸肽分子的結構與排列程序決定病毒對人的感染力度(這也是病毒重要突變的部位)。因爲病毒是靠S1來附屬到人體細胞表面上的ACE-2接受體。當此結合一形成,S蛋白的S2(圖片5右)即能溶解人體的細胞膜,打開了細胞膜,隨之便讓病毒的所有蛋白質及RNA基因進入細胞內,病毒便能開始在細胞內繁殖了。S 1蛋白質有一個受體結合域(RBD),是由222個氨基酸組成。RBD中有71個主要的氨基酸組成受體結合主域RBM(圖片5右藍點)。病毒通過RBD及RBM的氨基酸與人接受體ACE-2的氨基酸相結合是病毒感染人的先決條件。病毒與ACE-2氨基酸接合的力度,是與病毒對人不同程度的感染性有關。目前各種突變病毒對人的感染越耒越惡劣,都是因爲病毒座落在RBD尤其是在RBM氨基酸的改變,印度發現到極惡劣的Delta病毒能極凶猛傳播的能力是因爲病毒在這RBM中兩個氨基酸的突變(L452R, E484Q)。這些突變幫助病毒能夠更猛烈的攻擊,同時也容易逃避抗體的對抗(圖片6)。
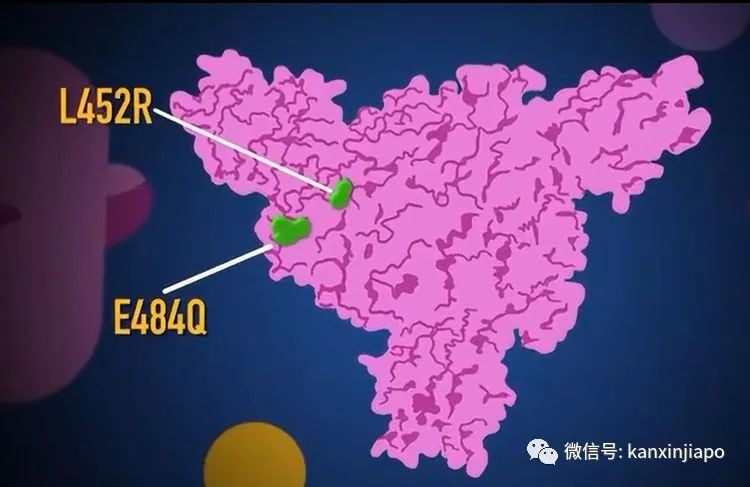
圖片5:冠狀病毒的結構是由RNA, S蛋白,N蛋白,E蛋白及M蛋白組成(左)。S蛋白(右)是由三蛋白聚體(trimer)組成. Trimer上端(黑點)是病毒與人接受體(ACE-2)結合時最主要的區域RBM。源自 NCBI網絡。新冠肺炎病毒是屬于RNA病毒;在所有的RNA病毒中,新冠肺炎病毒的基因是最大的,它是由三萬個核酸組成一單線、正性的RNA基因( Consists of 30,000 Nucleotides )。病毒的RNA是與病毒的核蛋白(N蛋白質)組合成螺旋式的核衣殼(Helical Nucleocapsid) (圖片5左)。核衣殼是處在病毒被膜(Envelope)的中心。病毒的被膜是由病毒的三種結構性蛋白質;M蛋白質,S蛋白質及E蛋白質聯合組成(圖片5,左)。在所有病毒結構性的蛋白質中(S, N, M, E. ), S蛋白質( Spike protein)扮演重要的角色,病毒是通過它的S蛋白質來啓動對人的感染。S蛋白質突露在病毒外膜,形成冠狀的突出蛋白體。當病毒開始感染人時,人體內的蛋白分解酵素(FURIN Enzyme)即會將病毒的S蛋白切開成S1及S2兩段。S1中的氨基酸肽分子的結構與排列程序決定病毒對人的感染力度(這也是病毒重要突變的部位)。因爲病毒是靠S1來附屬到人體細胞表面上的ACE-2接受體。當此結合一形成,S蛋白的S2(圖片5右)即能溶解人體的細胞膜,打開了細胞膜,隨之便讓病毒的所有蛋白質及RNA基因進入細胞內,病毒便能開始在細胞內繁殖了。S 1蛋白質有一個受體結合域(RBD),是由222個氨基酸組成。RBD中有71個主要的氨基酸組成受體結合主域RBM(圖片5右藍點)。病毒通過RBD及RBM的氨基酸與人接受體ACE-2的氨基酸相結合是病毒感染人的先決條件。病毒與ACE-2氨基酸接合的力度,是與病毒對人不同程度的感染性有關。目前各種突變病毒對人的感染越耒越惡劣,都是因爲病毒座落在RBD尤其是在RBM氨基酸的改變,印度發現到極惡劣的Delta病毒能極凶猛傳播的能力是因爲病毒在這RBM中兩個氨基酸的突變(L452R, E484Q)。這些突變幫助病毒能夠更猛烈的攻擊,同時也容易逃避抗體的對抗(圖片6)。 圖片6:網絡圖片。Delta病毒最主要的突變是有兩個氨基酸,L452R及E484Q的突變,這兩個突變都發生在病毒S蛋白的RBM (與人細胞ACE-2接合的主區)。C:社交管制與病毒突變Social Restriction and Viral MutationCOVID-19和所有的RNA病毒一樣,COVID-19病毒的基因是不穩定的。病毒感染人體後,每次在細胞內進行複制RNA時,常會出現差錯:RNA病毒可能排錯核酸組成的序列,有時也會遺漏一至多個核酸的組成(Misplace and/or Nucleotides deletion),因爲這樣的差錯造成了突變。病毒基因突變的幾率是與病毒的生長與繁殖的次數成正比的關系。因此當COVID-19疫情來臨時,即時控制疫情是非常重要的。假如沒有嚴格的控制疫情,正如在疫情的初期,在英國、美國和巴西,疫情的後期在印度、印尼甚至馬來西亞,新冠病毒不單單可以無約束的隨意感染人類,病毒也可在人體內無限制的繁殖,造成無約束的突變。新冠肺炎病毒的結構,型態及性能,都是由病毒的基因(RNA or DNA)來決定的。新冠病毒的基因,是由不同數量的核酸排列成不同的片段而形成。這些不同片段的基因,就是病毒各種蛋白質的代碼,從代碼指定的信息,編制出與病毒有關的結構性和非結構性的蛋白質。病毒結構性的蛋白質是形成病毒的結構及病毒的型態。非結構性的蛋白質酶(Enzymes)是主使病毒的繁殖及病毒的毒性功能。組成病毒結構主要的蛋白質有S蛋白,E蛋白,M蛋白及N蛋白(下圖:病毒基因圖)。
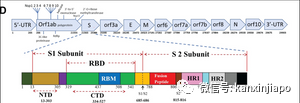
圖片6:網絡圖片。Delta病毒最主要的突變是有兩個氨基酸,L452R及E484Q的突變,這兩個突變都發生在病毒S蛋白的RBM (與人細胞ACE-2接合的主區)。C:社交管制與病毒突變Social Restriction and Viral MutationCOVID-19和所有的RNA病毒一樣,COVID-19病毒的基因是不穩定的。病毒感染人體後,每次在細胞內進行複制RNA時,常會出現差錯:RNA病毒可能排錯核酸組成的序列,有時也會遺漏一至多個核酸的組成(Misplace and/or Nucleotides deletion),因爲這樣的差錯造成了突變。病毒基因突變的幾率是與病毒的生長與繁殖的次數成正比的關系。因此當COVID-19疫情來臨時,即時控制疫情是非常重要的。假如沒有嚴格的控制疫情,正如在疫情的初期,在英國、美國和巴西,疫情的後期在印度、印尼甚至馬來西亞,新冠病毒不單單可以無約束的隨意感染人類,病毒也可在人體內無限制的繁殖,造成無約束的突變。新冠肺炎病毒的結構,型態及性能,都是由病毒的基因(RNA or DNA)來決定的。新冠病毒的基因,是由不同數量的核酸排列成不同的片段而形成。這些不同片段的基因,就是病毒各種蛋白質的代碼,從代碼指定的信息,編制出與病毒有關的結構性和非結構性的蛋白質。病毒結構性的蛋白質是形成病毒的結構及病毒的型態。非結構性的蛋白質酶(Enzymes)是主使病毒的繁殖及病毒的毒性功能。組成病毒結構主要的蛋白質有S蛋白,E蛋白,M蛋白及N蛋白(下圖:病毒基因圖)。 圖片7:結構性蛋白基因(S, E, M, N.)與非結構性蛋白基因(orfs)。結構性的蛋白氨基酸的數量(S = 1282 aa, E= 75 aa, M=222 aa, N=1259 aa, RBD= 223aa, RBM= 72aa,S = 1282 aa, M=222 aa, E= 75 aa, N=1259 aa, RBD= 223aa, RBM= 72aa)這些都是最主要的蛋白質,缺一不可。S蛋白是座落在病毒表面的剌突體(Spike Protein), 病毒是依靠S蛋白,結合到人體細胞表面的接受體(ACE-2) 而開始對人類的感染。疫情失控導致病毒突變,影響病毒對人類的感染性及感染力度,通常感染的力度是與病毒S蛋白突變的程度有關。在病毒的四種結構性蛋白質中,S蛋白與N蛋白影響的的突變率比較高,分別爲S48% , N39%. M蛋白與E蛋白受影響的突変率比較低,分別爲M9%, E蛋白比較穩定,受影響的突變幾率是在4%左右。病毒非結構性的蛋白質基因(ORFs等)比較穩定,很少突變。病毒非結構性的基因主要是刺激病毒酶(enzymes)的産生,病毒酶的功能是引導病毒的繁殖,行使病毒對人破壞的毒性。假如病毒喪失了制造非結構性的蛋白質,病毒就將失去了宅的毒性,也失去了生存的能力。D:突變病毒的替換 Replacement of Mutant Viruses新冠肺炎病毒自從在2019年底在中國武漢被發現以來,病毒的基因就已經過了上百上千次的突變;大部分的突變沒有明顯的改變病毒的毒性,對人並不會有什麽大的影響,可是近二十個月內,先後有數次(大約有十次)的突變對人類産生比較顯著的傷害。新冠病毒最早期的突變是發生在2019年底至2020年初,中國病毒學家發現到最初傳播的新冠病是“S”病毒,S是組成病毒22種氨基酸一,稱“Serine,S ”的氨基酸。S氨基酸是座落在新冠肺炎病毒基因的末端(ORF 8)段,病毒在人體內生長複制時出了差錯,S氨基酸 被“L ”氨基酸取代了,只是一個氨基酸的差異,病毒就産生了突變,分出了 “L ”毒株。S與L兩毒株同時在中國傳播。比較上L病毒的感染力與致病力比S強得多;L與S兩病毒都能在人與人之間同時的感染。L病毒的傳染速度快,患者由輕微的症狀可以很快的惡化造成肺炎甚至死亡。當時雖然還設有完成疫苗的研制,爲了避免疫情的惡化,中國官方即採取嚴厲的公共衛生管制措施,很快的,惡劣的L病毒即被控制了下來,L病毒也就慢慢的消失了。2020年初流行于中國的新冠肺炎病毒(SARS-CoV-2)幾乎只有原始的新冠肺炎病毒D614品種,與此同時(或之前), D614新冠肺炎病毒也在歐美蔓延。在歐美由于沒有嚴格的社會管制措施,D614病毒産生了突變,突變的地方是座落于病毒S蛋白質基因的614的部位,在614 原有的D氨基酸被G氨基酸取代。由于G氨基酸的介入,G氨基酸松弛了(Loosen The S protein)病毒S蛋白質的結構,使病毒更容易和人細胞的接受體(ACE2 )結合,增加病毒的感染力(下圖)。
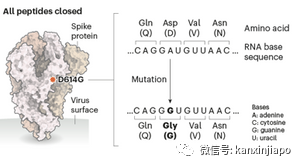
圖片7:結構性蛋白基因(S, E, M, N.)與非結構性蛋白基因(orfs)。結構性的蛋白氨基酸的數量(S = 1282 aa, E= 75 aa, M=222 aa, N=1259 aa, RBD= 223aa, RBM= 72aa,S = 1282 aa, M=222 aa, E= 75 aa, N=1259 aa, RBD= 223aa, RBM= 72aa)這些都是最主要的蛋白質,缺一不可。S蛋白是座落在病毒表面的剌突體(Spike Protein), 病毒是依靠S蛋白,結合到人體細胞表面的接受體(ACE-2) 而開始對人類的感染。疫情失控導致病毒突變,影響病毒對人類的感染性及感染力度,通常感染的力度是與病毒S蛋白突變的程度有關。在病毒的四種結構性蛋白質中,S蛋白與N蛋白影響的的突變率比較高,分別爲S48% , N39%. M蛋白與E蛋白受影響的突変率比較低,分別爲M9%, E蛋白比較穩定,受影響的突變幾率是在4%左右。病毒非結構性的蛋白質基因(ORFs等)比較穩定,很少突變。病毒非結構性的基因主要是刺激病毒酶(enzymes)的産生,病毒酶的功能是引導病毒的繁殖,行使病毒對人破壞的毒性。假如病毒喪失了制造非結構性的蛋白質,病毒就將失去了宅的毒性,也失去了生存的能力。D:突變病毒的替換 Replacement of Mutant Viruses新冠肺炎病毒自從在2019年底在中國武漢被發現以來,病毒的基因就已經過了上百上千次的突變;大部分的突變沒有明顯的改變病毒的毒性,對人並不會有什麽大的影響,可是近二十個月內,先後有數次(大約有十次)的突變對人類産生比較顯著的傷害。新冠病毒最早期的突變是發生在2019年底至2020年初,中國病毒學家發現到最初傳播的新冠病是“S”病毒,S是組成病毒22種氨基酸一,稱“Serine,S ”的氨基酸。S氨基酸是座落在新冠肺炎病毒基因的末端(ORF 8)段,病毒在人體內生長複制時出了差錯,S氨基酸 被“L ”氨基酸取代了,只是一個氨基酸的差異,病毒就産生了突變,分出了 “L ”毒株。S與L兩毒株同時在中國傳播。比較上L病毒的感染力與致病力比S強得多;L與S兩病毒都能在人與人之間同時的感染。L病毒的傳染速度快,患者由輕微的症狀可以很快的惡化造成肺炎甚至死亡。當時雖然還設有完成疫苗的研制,爲了避免疫情的惡化,中國官方即採取嚴厲的公共衛生管制措施,很快的,惡劣的L病毒即被控制了下來,L病毒也就慢慢的消失了。2020年初流行于中國的新冠肺炎病毒(SARS-CoV-2)幾乎只有原始的新冠肺炎病毒D614品種,與此同時(或之前), D614新冠肺炎病毒也在歐美蔓延。在歐美由于沒有嚴格的社會管制措施,D614病毒産生了突變,突變的地方是座落于病毒S蛋白質基因的614的部位,在614 原有的D氨基酸被G氨基酸取代。由于G氨基酸的介入,G氨基酸松弛了(Loosen The S protein)病毒S蛋白質的結構,使病毒更容易和人細胞的接受體(ACE2 )結合,增加病毒的感染力(下圖)。 圖片8: Nature網絡圖片。圖片顯示,病毒在S蛋白氨基酸614部位的D氨基酸被G氨基酸取代後,病毒對人的感染力即加倍的増加。G614變種實際上是在2020年1月中就開始在歐洲/英國流行,當時G614是佔總體疫情的5%左右,95%的疫情是因D614的感染所造成的。由于G 614變種的傳播力強,在六個星期內,似乎60%的英國疫情都是因爲G614的感染而形成的。到了2020年6月中,D614被突変的毒株G614取代了,清一色的疫情都是因G614的感染而造成的(圖片9)。
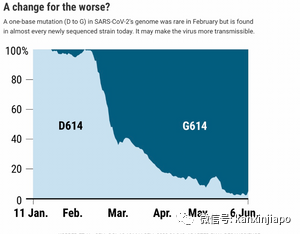
圖片8: Nature網絡圖片。圖片顯示,病毒在S蛋白氨基酸614部位的D氨基酸被G氨基酸取代後,病毒對人的感染力即加倍的増加。G614變種實際上是在2020年1月中就開始在歐洲/英國流行,當時G614是佔總體疫情的5%左右,95%的疫情是因D614的感染所造成的。由于G 614變種的傳播力強,在六個星期內,似乎60%的英國疫情都是因爲G614的感染而形成的。到了2020年6月中,D614被突変的毒株G614取代了,清一色的疫情都是因G614的感染而造成的(圖片9)。 圖片9:網絡圖片。2020年12月,英國又出現了一新突變,這突變是發生在英國東南部,G614病毒突變成B.1.1.7.,也稱爲Alpha variant病毒。Alpha病毒最主要的突變是N501Y的突變,N501Y指的是病毒S蛋白質在RBM地區的501部位,原本的N氨基酸被Y氨基酸取代。N氨基酸與人的ACE-2本來是有少許互相排斥的作用,現被Y氨基酸取代,而Y氨基酸與人的ACE-2接受體是比較親密些,增加病毒S蛋白與ACE-2接合的力度,促使Alpha變種有高出70%的感染力。除了N501Y突變之外,Alpha病毒也保留了G614部位的突變。此外Alpha病毒S蛋白的其他部位也有突變,該包括P681H。P618H的突變改變病毒S蛋白質的結構,提高病毒與細胞結合的適應度,幫助病毒更容易滲透入人細胞。Alpha的突變中也包括刪除兩處基因的氨基酸,H69/V70和部分在ORF1b氨基酸的刪除,這部份基因的刪除,能幫助病毒逃避人抗體的攻擊及脫離被細胞免疫CTL的毀滅。由于全球全面接種疫苗尚未到位,新冠病毒的突變加據感染力的新變種處處可見,可是病毒的突變也不一定全是壞事。新加坡的良性新冠肺炎病毒 Benign SARS-2 in Singapore
圖片9:網絡圖片。2020年12月,英國又出現了一新突變,這突變是發生在英國東南部,G614病毒突變成B.1.1.7.,也稱爲Alpha variant病毒。Alpha病毒最主要的突變是N501Y的突變,N501Y指的是病毒S蛋白質在RBM地區的501部位,原本的N氨基酸被Y氨基酸取代。N氨基酸與人的ACE-2本來是有少許互相排斥的作用,現被Y氨基酸取代,而Y氨基酸與人的ACE-2接受體是比較親密些,增加病毒S蛋白與ACE-2接合的力度,促使Alpha變種有高出70%的感染力。除了N501Y突變之外,Alpha病毒也保留了G614部位的突變。此外Alpha病毒S蛋白的其他部位也有突變,該包括P681H。P618H的突變改變病毒S蛋白質的結構,提高病毒與細胞結合的適應度,幫助病毒更容易滲透入人細胞。Alpha的突變中也包括刪除兩處基因的氨基酸,H69/V70和部分在ORF1b氨基酸的刪除,這部份基因的刪除,能幫助病毒逃避人抗體的攻擊及脫離被細胞免疫CTL的毀滅。由于全球全面接種疫苗尚未到位,新冠病毒的突變加據感染力的新變種處處可見,可是病毒的突變也不一定全是壞事。新加坡的良性新冠肺炎病毒 Benign SARS-2 in Singapore 圖片10:網絡圖片:SARS-CoV2的RNA基因組合圖。變種病毒的基因在非結構性基因ORF7b – ORF8部位,缺少了382個核酸發表在Lancet, August 18 2020, B. E. Young et al等科學家發現有一突變毒株(382 NTs deletion at ORF7b-ORF8)出現在新加坡:Young et.al.在2020年1月22日到3月21日期間,從七所醫院總共收集了278名新冠肺炎病毒的病患者的資料,觀察他們的病例時發現到有92名(72%)患者中的肺炎病症,是由原本病毒株(Wild-type, SARS-2,D614)的感染所造成的;29名(22%)是受到變種病毒的感染,這變種病毒的基因在ORF7b – ORF8部位之間缺少了382個核酸(見上圖右上角,382 Nucleotides missing)。另外10名病患(8%)體內的病毒,有原始與突變的兩種病毒(混合感染?),但再做進一步的探索,發現到這10名患者體內原本的病毒,也逐漸被變種病毒取代。變種病毒的感染症狀都是比較溫和,病症輕微不必住院治療,而且很快痊愈。從他們的觀察報告可以推測,病毒基因的ORF8片段可能是含有對人類非常不利的基因,當這些基因表達時,會引起患者炎性細胞因子的增生(Inflammatory Cytokines Secretion ), 過多炎性細胞分孑(TNF, IL-6, IL-17)的分泌,會形成了致命的細胞分子風暴(Cytokines storms)。炎性的細胞因子,對人體內表層細胞,尤其是肺部呼吸細胞的破壞性是非常大的。而在突變的病毒,在其ORF7-8中欠缺了382個核酸,此種的突變反而是好的,此突變品種是可考慮做爲滅毒疫苗的好毒株。許多現象顯示,取代英國Alpha的病毒是印度超惡劣的Delta病毒株。
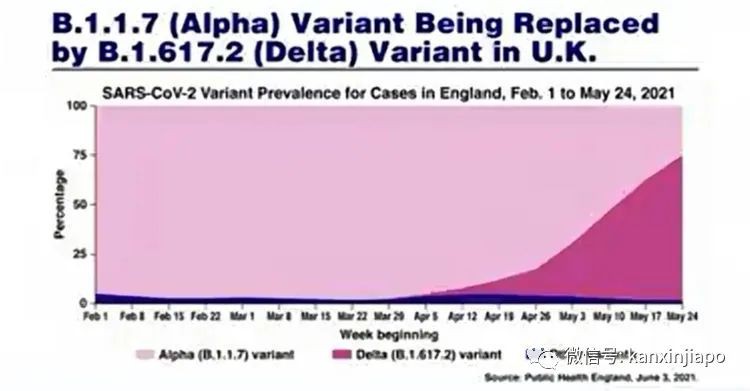
圖片10:網絡圖片:SARS-CoV2的RNA基因組合圖。變種病毒的基因在非結構性基因ORF7b – ORF8部位,缺少了382個核酸發表在Lancet, August 18 2020, B. E. Young et al等科學家發現有一突變毒株(382 NTs deletion at ORF7b-ORF8)出現在新加坡:Young et.al.在2020年1月22日到3月21日期間,從七所醫院總共收集了278名新冠肺炎病毒的病患者的資料,觀察他們的病例時發現到有92名(72%)患者中的肺炎病症,是由原本病毒株(Wild-type, SARS-2,D614)的感染所造成的;29名(22%)是受到變種病毒的感染,這變種病毒的基因在ORF7b – ORF8部位之間缺少了382個核酸(見上圖右上角,382 Nucleotides missing)。另外10名病患(8%)體內的病毒,有原始與突變的兩種病毒(混合感染?),但再做進一步的探索,發現到這10名患者體內原本的病毒,也逐漸被變種病毒取代。變種病毒的感染症狀都是比較溫和,病症輕微不必住院治療,而且很快痊愈。從他們的觀察報告可以推測,病毒基因的ORF8片段可能是含有對人類非常不利的基因,當這些基因表達時,會引起患者炎性細胞因子的增生(Inflammatory Cytokines Secretion ), 過多炎性細胞分孑(TNF, IL-6, IL-17)的分泌,會形成了致命的細胞分子風暴(Cytokines storms)。炎性的細胞因子,對人體內表層細胞,尤其是肺部呼吸細胞的破壞性是非常大的。而在突變的病毒,在其ORF7-8中欠缺了382個核酸,此種的突變反而是好的,此突變品種是可考慮做爲滅毒疫苗的好毒株。許多現象顯示,取代英國Alpha的病毒是印度超惡劣的Delta病毒株。 圖片11:網絡圖片根據英國的數據,印度Delta病毒的感染率比起英國Alpha病毒感染率增加了七至十倍,病毒在人體內的生長率可比原本病毒高出1000倍。在英國(2021年2月) Delta病毒大約在兩個月內(4月中至6月)就取代了Alpha病毒對人類的感染(圖)。比起當初的疫情(2020年2月 ), G614病毒則經過四到五個月的時間才完全的取代D614病毒(圖)。可見Delta病毒的傳播速度比G614強得多。組成病毒S蛋白質裏面的氨基酸産生重要改變時,新的變種病毒便會産生。自從2020年疫情開始以來,似乎每兩個月就會有新的變種出現(圖片12)。
圖片11:網絡圖片根據英國的數據,印度Delta病毒的感染率比起英國Alpha病毒感染率增加了七至十倍,病毒在人體內的生長率可比原本病毒高出1000倍。在英國(2021年2月) Delta病毒大約在兩個月內(4月中至6月)就取代了Alpha病毒對人類的感染(圖)。比起當初的疫情(2020年2月 ), G614病毒則經過四到五個月的時間才完全的取代D614病毒(圖)。可見Delta病毒的傳播速度比G614強得多。組成病毒S蛋白質裏面的氨基酸産生重要改變時,新的變種病毒便會産生。自從2020年疫情開始以來,似乎每兩個月就會有新的變種出現(圖片12)。 圖片12:網絡圖片。近20個月的疫情中新冠病毒至少有超過10次重要的突變。突變的部位主要是在病毒的S蛋白。尤其是發生在S蛋白RBD及RBM的部位。在所知的變種病毒: Alpha, Beta, Gamma, Delta, Epsilon, Delta+,lota. Lambda等等變種病毒,印度的Delta突種是極度惡劣的。Delta是在許多突變病毒突變中的再突變,Delta病毒最首要的突變是發生在最敏感與ACE-2接合的S蛋白主區RBM。在這主區有兩個部位的突變,L452R及E484Q。L452R是Delta病毒特有的突變,另一突變E484Q,是在其他突變病毒(包括南非Beta,巴西Gamma,美國紐約B.1.512)E484K突變中的突變成E484Q。
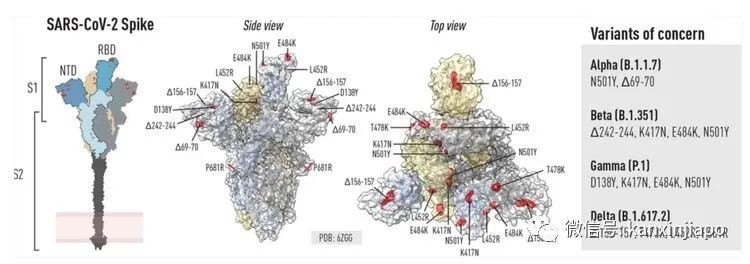
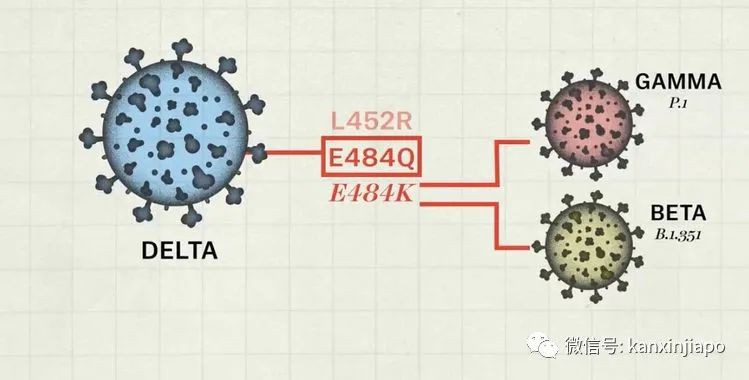
圖片12:網絡圖片。近20個月的疫情中新冠病毒至少有超過10次重要的突變。突變的部位主要是在病毒的S蛋白。尤其是發生在S蛋白RBD及RBM的部位。在所知的變種病毒: Alpha, Beta, Gamma, Delta, Epsilon, Delta+,lota. Lambda等等變種病毒,印度的Delta突種是極度惡劣的。Delta是在許多突變病毒突變中的再突變,Delta病毒最首要的突變是發生在最敏感與ACE-2接合的S蛋白主區RBM。在這主區有兩個部位的突變,L452R及E484Q。L452R是Delta病毒特有的突變,另一突變E484Q,是在其他突變病毒(包括南非Beta,巴西Gamma,美國紐約B.1.512)E484K突變中的突變成E484Q。 圖片13:網絡圖片。印度的Delta病毒在RBM部位有兩大突變(L452R及E484Q), E484Q的突變,是巴西Gamma及南非Bata E484K的突變中的突變。由此可見印度Delta病毒具有頑強的侵襲力。近日Delta又增加了另一旁支Delta Plus。Delta Plus是在Delta所有的突變的基礎上再增加另一突變K417N。這一突變與來自尼泊爾的新冠病毒有一定的關系。是否會更加強病毒的感染性,或者能更容易逃避人體免疫系統的管制,目前還在探索中。E:疫苗的研發與免疫反應 Vaccines Development and Immunity正當中國武漢病毒實驗室,檢驗出新冠肺炎病毒時,在第一時間即將病毒完整RNA基因組合與結構圖公布于世;美國NIH便即時的根據新冠病毒基因的排列圖,人工設計了能在人體內表達病毒S蛋白的疫苗,這就是新冠肺炎病毒Moderna制作的mRNA疫苗。在很短的時間(10個月)幾乎完成了第三期疫苗的安全性及有效性的臨床試驗,被FDA批准應急使用。與此同吋,德國的Bio-N-Tech (mRNA),英國的Astra-Zeneca,羅斯的Sputnik,美國的Johnson and Johnson也先後分別研制了mRNA或者以腺病毒爲載體的重組DNA疫苗(Adenovirus DNA recombinant vaccine)。無論是mRNA或者是以rDNA做基礎的疫苗,都是以表達病毒的S蛋白的疫苗。而在中國制造的滅活疫苗就有不一樣(Inactivated vaccine),滅活疫苗的成分除了與mRNA, rDNA一樣的能表達病毒的S蛋白之外,滅活疫苗還包括病毒其他結構性的蛋白質;E、M和N蛋白,也包括了非結構性的病毒蛋白(見圖,ORFs)。自然界中,新冠肺炎病毒減染人類時,病毒是依賴其S 蛋白附屬到人的呼吸道表面細胞的接受體(ACE-2)再進入人的細胞內,完成對人的感染。爲了防止病毒的感染,由滅活疫苗産生的的抗體只要能抑制病毒的S蛋白,阻止病毒接合到人的ACE-2接受體,必然可以預防病毒的感染。利用病毒S蛋白的代碼(mRNA 或者rDNA )編制成疫苗注射入人體內,是讓人的細胞根據病毒代碼的信息,制造出類似病毒但沒有毒性的S蛋白質。這種沒有毒性的S蛋白質能引導人的免疫系統,制造專一對抗病毒的抗體及對病毒有毒性的T淋巴細胞(CTL)。人的免疫反應有先天性免疫及後天性的適應性免疫(Innate and Adaptive immunities )反應。通過注射疫苗,引起的免疫反應是後天適應性的免疫反應。適應性免疫Adaptive immunity又分爲兩種:體液免疫反應(Humoral immune response)和細胞免疫反應(Cellular Immune response)。病毒侵襲時,人的體液免疫(Humoral immunity)和細胞免疫(Cellular Immunity),分工合作的來對抗病毒的侵害。1、體液反應主要的特點是産生抗體(Specific Antibodies)。讓這些抗體包圍住病毒的S蛋白,中和了病毒,阻止病毒接觸到表皮細胞的ACE-2接受體,預防了感染(下圖)。
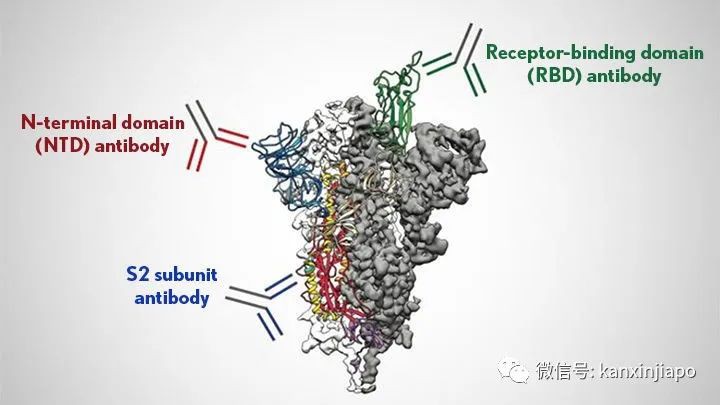
圖片13:網絡圖片。印度的Delta病毒在RBM部位有兩大突變(L452R及E484Q), E484Q的突變,是巴西Gamma及南非Bata E484K的突變中的突變。由此可見印度Delta病毒具有頑強的侵襲力。近日Delta又增加了另一旁支Delta Plus。Delta Plus是在Delta所有的突變的基礎上再增加另一突變K417N。這一突變與來自尼泊爾的新冠病毒有一定的關系。是否會更加強病毒的感染性,或者能更容易逃避人體免疫系統的管制,目前還在探索中。E:疫苗的研發與免疫反應 Vaccines Development and Immunity正當中國武漢病毒實驗室,檢驗出新冠肺炎病毒時,在第一時間即將病毒完整RNA基因組合與結構圖公布于世;美國NIH便即時的根據新冠病毒基因的排列圖,人工設計了能在人體內表達病毒S蛋白的疫苗,這就是新冠肺炎病毒Moderna制作的mRNA疫苗。在很短的時間(10個月)幾乎完成了第三期疫苗的安全性及有效性的臨床試驗,被FDA批准應急使用。與此同吋,德國的Bio-N-Tech (mRNA),英國的Astra-Zeneca,羅斯的Sputnik,美國的Johnson and Johnson也先後分別研制了mRNA或者以腺病毒爲載體的重組DNA疫苗(Adenovirus DNA recombinant vaccine)。無論是mRNA或者是以rDNA做基礎的疫苗,都是以表達病毒的S蛋白的疫苗。而在中國制造的滅活疫苗就有不一樣(Inactivated vaccine),滅活疫苗的成分除了與mRNA, rDNA一樣的能表達病毒的S蛋白之外,滅活疫苗還包括病毒其他結構性的蛋白質;E、M和N蛋白,也包括了非結構性的病毒蛋白(見圖,ORFs)。自然界中,新冠肺炎病毒減染人類時,病毒是依賴其S 蛋白附屬到人的呼吸道表面細胞的接受體(ACE-2)再進入人的細胞內,完成對人的感染。爲了防止病毒的感染,由滅活疫苗産生的的抗體只要能抑制病毒的S蛋白,阻止病毒接合到人的ACE-2接受體,必然可以預防病毒的感染。利用病毒S蛋白的代碼(mRNA 或者rDNA )編制成疫苗注射入人體內,是讓人的細胞根據病毒代碼的信息,制造出類似病毒但沒有毒性的S蛋白質。這種沒有毒性的S蛋白質能引導人的免疫系統,制造專一對抗病毒的抗體及對病毒有毒性的T淋巴細胞(CTL)。人的免疫反應有先天性免疫及後天性的適應性免疫(Innate and Adaptive immunities )反應。通過注射疫苗,引起的免疫反應是後天適應性的免疫反應。適應性免疫Adaptive immunity又分爲兩種:體液免疫反應(Humoral immune response)和細胞免疫反應(Cellular Immune response)。病毒侵襲時,人的體液免疫(Humoral immunity)和細胞免疫(Cellular Immunity),分工合作的來對抗病毒的侵害。1、體液反應主要的特點是産生抗體(Specific Antibodies)。讓這些抗體包圍住病毒的S蛋白,中和了病毒,阻止病毒接觸到表皮細胞的ACE-2接受體,預防了感染(下圖)。 圖片14:網絡圖片。對抗病毒S蛋白的抗體,包圍住病毒的S蛋白,阻止S蛋白接合到人的ACE-2接受體。抗體結合上了病毒RBD (右上)即能中和了病毒。抗體結合上了S蛋白的NTD(左上)。NTD的氨基酸結構形式是與所有冠狀病毒共享的。抗休對抗S蛋白的S2 (左下),可以阻止病毒溶解人的細胞膜。2、疫苗也引起人的“細胞免疫”反應,(Cellular Immune response)。細胞免疫主要的是激活人體的CD8淋巴細胞,讓它擴張形成了“有細胞毒性的淋巴細胞” (Cytotoxic T Lymphocyte) CTL也稱作T Killer cell,主要的功能是消滅及清理已被病毒感染的細胞,阻止病毒産生病變造成疾病的惡化(下圖)。
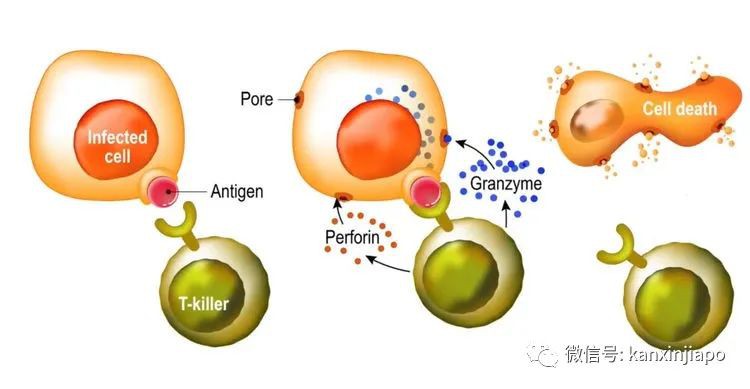
圖片14:網絡圖片。對抗病毒S蛋白的抗體,包圍住病毒的S蛋白,阻止S蛋白接合到人的ACE-2接受體。抗體結合上了病毒RBD (右上)即能中和了病毒。抗體結合上了S蛋白的NTD(左上)。NTD的氨基酸結構形式是與所有冠狀病毒共享的。抗休對抗S蛋白的S2 (左下),可以阻止病毒溶解人的細胞膜。2、疫苗也引起人的“細胞免疫”反應,(Cellular Immune response)。細胞免疫主要的是激活人體的CD8淋巴細胞,讓它擴張形成了“有細胞毒性的淋巴細胞” (Cytotoxic T Lymphocyte) CTL也稱作T Killer cell,主要的功能是消滅及清理已被病毒感染的細胞,阻止病毒産生病變造成疾病的惡化(下圖)。 圖片15:圖片顯示被病毒感染的細胞(左)通過自身的MHC1表達病毒正在複制中的任何蛋白質到細胞表面時,T-Killer CTL便即刻的扣住MHC-1中的病毒蛋白,隨後便分泌醇素(中)在細胞膜上擊洞,同時由洞口注射毒液Granzyme。Granzyme將細胞核中的DNA切碎(Apoptosis),消滅被病毒感染的細胞(右)。源自Pearson Education Inc. Publishing as Pearson, Benjamin, Cummings.接受核酸疫苗mRNA疫苗,或rDNA疫苗,或滅活疫苗的接種,這三種疫苗自然的會引導人的免疫系統産生對抗病毒S蛋白的抗體及CTL,專一殺滅表達S蛋白的被感染的細胞。可是,當病毒感染的細胞,表達在細胞膜上的不是S蛋白,而是病毒的其他結構性蛋白或者非結構性的蛋白(來自ORFs的蛋白質),在此情形下,能殺滅被病毒感染的細胞的CTL只能是來自接受滅活疫苗的接種者,因爲滅活疫苗的成分除了含有有S蛋白之外,也包含了病毒其他結構性蛋白及非結構性的蛋白質。滅活疫苗引起的免疫反應是多樣化的,對人體的保護面更全面。F:突變對疫苗的影響 Mutation and Vaccine Efficacy目前世界衛生組織認可的所有疫苗都是以D614病毒刺突S蛋白氨基酸排列順序爲標准,由疫苗産生的體液免疫(抗體)和細胞免疫,都只認識原本D614病毒的S蛋白質的結構。病毒突變後改變了原來病毒S蛋白質的結構,或者改變了氨基酸的排列順序,多少都會影響由原來疫苗産生抗病毒的抗體及CTL的效力。可是實際的情形並非完全如此:病毒的S蛋白是由1282個氨基酸組成,其中主要的有72個座落在RBM的氨基酸。72個氨基酸是可以引起12個重要抗體(中和性抗體(Neutralizing antibodies)的産生。惡劣的Delta變種在RBM部位有兩個氨基酸的改變,這對疫苗産生有中和効力的抗體的影響大約是17%左右。可是疫苗引起的CTL,其功能則不會因爲突変病毒的感染有顯著的改變。CTL對抗的不只是座落在RBD包括RBM的氨基酸,而是病毒整體S蛋白的1282個氨基酸構成的257抗原決定簇(257 epitopes ),病毒少于10個氨基酸的突變,對CTL的影響就起不了多大的作用。世衛組織也認可由中國生産的滅活疫苗,由滅活疫苗引起的體液免疫的抗體與細胞免疫反應的CTL,都能更全面性的對抗新冠肺炎病毒。G:自然免疫 Natural Immunity普通的冠狀病毒對人類的健康是沒有顯著的威脅的。因爲普通冠狀病毒與普通流行性感冒病毒的感染症狀類似;流鼻涕,打噴嚏,發微燒,咳嗽,數日內也就複原了。普通冠狀病毒致病率底,平時人們也沒有察覺到它們的存在。實際上冠狀病毒在人類社會可能是有千年甚至萬年的曆史了。只是到了近代,有了細胞培養技術及器官培養技術的應用,再加上快速的核酸檢測方法,許多以往不爲人知的普通冠狀病毒包括近期三種非常惡性的肺炎冠狀病毒才漸漸地露面于世。那些能夠感染人類的七種冠狀病毒,其中四種是比較良性,也很普遍的流行于人類社會。據調查,似乎每一個人一生中都會有被其中任何一品種感染。這些病毒與病毒之間,它們基因的結構非常相似,它們與其他比較惡性冠狀病毒(包括SARS-CoV-2)的基因也約有60%至85%類似之處。故此當人受到任何七種病毒的感染,人體産生的免疫反應都會在某種程度上起交叉保護作用的。免疫系統中的體液免疫與細胞免疫,對人體有不同的保護功能與保護力度;體液免疫(抗體)主要的功能是預防病毒的感染。抗體是通過和病毒表面的S蛋白結合,中和了病毒,阻止病毒附屬到人體細胞,防止病毒滲入細胞。細胞免疫産生的有CD4及CD8兩種不同功能細胞:CD8細胞(也稱爲CTL)主要的功能是辨認及殺滅己被病毒感染的細胞。CD4的功能是分泌不同的細胞因子,通過細胞因子協調體液免疫及細胞免疫功能(圖片16)。
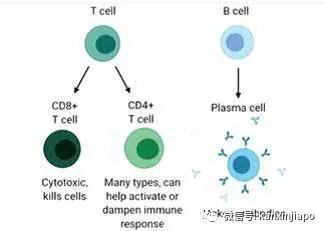
圖片15:圖片顯示被病毒感染的細胞(左)通過自身的MHC1表達病毒正在複制中的任何蛋白質到細胞表面時,T-Killer CTL便即刻的扣住MHC-1中的病毒蛋白,隨後便分泌醇素(中)在細胞膜上擊洞,同時由洞口注射毒液Granzyme。Granzyme將細胞核中的DNA切碎(Apoptosis),消滅被病毒感染的細胞(右)。源自Pearson Education Inc. Publishing as Pearson, Benjamin, Cummings.接受核酸疫苗mRNA疫苗,或rDNA疫苗,或滅活疫苗的接種,這三種疫苗自然的會引導人的免疫系統産生對抗病毒S蛋白的抗體及CTL,專一殺滅表達S蛋白的被感染的細胞。可是,當病毒感染的細胞,表達在細胞膜上的不是S蛋白,而是病毒的其他結構性蛋白或者非結構性的蛋白(來自ORFs的蛋白質),在此情形下,能殺滅被病毒感染的細胞的CTL只能是來自接受滅活疫苗的接種者,因爲滅活疫苗的成分除了含有有S蛋白之外,也包含了病毒其他結構性蛋白及非結構性的蛋白質。滅活疫苗引起的免疫反應是多樣化的,對人體的保護面更全面。F:突變對疫苗的影響 Mutation and Vaccine Efficacy目前世界衛生組織認可的所有疫苗都是以D614病毒刺突S蛋白氨基酸排列順序爲標准,由疫苗産生的體液免疫(抗體)和細胞免疫,都只認識原本D614病毒的S蛋白質的結構。病毒突變後改變了原來病毒S蛋白質的結構,或者改變了氨基酸的排列順序,多少都會影響由原來疫苗産生抗病毒的抗體及CTL的效力。可是實際的情形並非完全如此:病毒的S蛋白是由1282個氨基酸組成,其中主要的有72個座落在RBM的氨基酸。72個氨基酸是可以引起12個重要抗體(中和性抗體(Neutralizing antibodies)的産生。惡劣的Delta變種在RBM部位有兩個氨基酸的改變,這對疫苗産生有中和効力的抗體的影響大約是17%左右。可是疫苗引起的CTL,其功能則不會因爲突変病毒的感染有顯著的改變。CTL對抗的不只是座落在RBD包括RBM的氨基酸,而是病毒整體S蛋白的1282個氨基酸構成的257抗原決定簇(257 epitopes ),病毒少于10個氨基酸的突變,對CTL的影響就起不了多大的作用。世衛組織也認可由中國生産的滅活疫苗,由滅活疫苗引起的體液免疫的抗體與細胞免疫反應的CTL,都能更全面性的對抗新冠肺炎病毒。G:自然免疫 Natural Immunity普通的冠狀病毒對人類的健康是沒有顯著的威脅的。因爲普通冠狀病毒與普通流行性感冒病毒的感染症狀類似;流鼻涕,打噴嚏,發微燒,咳嗽,數日內也就複原了。普通冠狀病毒致病率底,平時人們也沒有察覺到它們的存在。實際上冠狀病毒在人類社會可能是有千年甚至萬年的曆史了。只是到了近代,有了細胞培養技術及器官培養技術的應用,再加上快速的核酸檢測方法,許多以往不爲人知的普通冠狀病毒包括近期三種非常惡性的肺炎冠狀病毒才漸漸地露面于世。那些能夠感染人類的七種冠狀病毒,其中四種是比較良性,也很普遍的流行于人類社會。據調查,似乎每一個人一生中都會有被其中任何一品種感染。這些病毒與病毒之間,它們基因的結構非常相似,它們與其他比較惡性冠狀病毒(包括SARS-CoV-2)的基因也約有60%至85%類似之處。故此當人受到任何七種病毒的感染,人體産生的免疫反應都會在某種程度上起交叉保護作用的。免疫系統中的體液免疫與細胞免疫,對人體有不同的保護功能與保護力度;體液免疫(抗體)主要的功能是預防病毒的感染。抗體是通過和病毒表面的S蛋白結合,中和了病毒,阻止病毒附屬到人體細胞,防止病毒滲入細胞。細胞免疫産生的有CD4及CD8兩種不同功能細胞:CD8細胞(也稱爲CTL)主要的功能是辨認及殺滅己被病毒感染的細胞。CD4的功能是分泌不同的細胞因子,通過細胞因子協調體液免疫及細胞免疫功能(圖片16)。 圖片16:源自 international autoimmune encephalitis society。人的免疫系統主要分爲B淋巴系統與T淋巴系統。當B淋細胞(右邊)受到抗原的剌激時,B淋巴球即變化成Plasma細胞,由此産生抗體。T淋巴系統可分化出CD8 CTL細胞,CTL可以直接殺死被病毒感染的細胞。T淋巴系統也分化出CD4淋巴細胞,CD4淋巴細胞分泌兩種Th-1與Th-2協調免疫功能的細胞因子,Th-1協調CTL功能,Th-2協調B細胞的抗體功能。受到病毒感染後,免疫系統都會有“記憶性的免疫細胞”(Memory B and Memory T lymphocytes)的産生。病愈後,MB和MT細胞還會遺留在免疫系統內。遺留在體內的MB和MT淋巴細胞是有不同的壽命;以2003年的SARS-1病毒爲例,SARS-1的MB細胞壽命比較短,可是MT細胞的壽命可達到12年以上。人若再次的受到同樣的病毒或者相似的病毒感染時,MB和MT都會分別被激活,同時也會大量的繁殖。激活了的MB會轉變爲血漿細胞(Plasma cell), 産生許多抗體(圖片16)。被激活了的MT也會大量的繁殖,生産出CD8 CTL (killer T)及CD4 T helper淋巴細胞(圖片16)。但是新冠肺炎病毒的感染,尤其是感染力很強的變種病毒(比如Alpha病毒與Delta病毒)都是由上呼吸器官開始,抗體(包括由接種目前的疫苗産生的抗體)及CTL在上呼吸道的防疫功能是非常衰弱的,不能控制病毒在上呼吸器官的感染及産生病變。只有當病毒往下呼吸道蔓延時,疫苗産生的抗體及CTL才能發揮作用,才能阻止病毒對下呼吸道的侵害及造成病變。這就說明了爲何新冠病毒在上呼吸道的感染力隨著突變越來越強,但是當病毒到下呼吸道,因爲有了接種疫苗引起的抗體及CTL的保護,病毒的毒性就起不了作用了。G1:現有的自然免疫 Existing Natural Immunity近期科學家Alba Grifoni et al等人,研討新冠肺炎病患者和健康人群免疫系統中的MT (對抗新冠肺炎病毒的記憶性丅細胞)含量,他們發現到受新冠肺炎病毒感染後,100%的患者血液中含有大量的MT (對抗病毒的記憶性丅細胞),同時他們也很驚奇的發現到有40%至60%的普通人(沒有受過新冠肺炎病毒的感染者)也含有抗新冠病毒的MT存在。這說明,普通人群可能是經常有接觸到普通感冒的冠狀病毒的感染,體內已經培養出許多能對抗新冠肺炎病毒的MT,MT隨時都能保護普通人群不受到病毒嚴重的傷害。類似的現象也在紐約觀察到;有40%的普通民衆有對抗病毒的MT細胞存在。連續的,約有34%, 28%及50%的普通人群,在德國、荷蘭及新加坡也有對抗新冠病毒的MT細胞的存在。在新加坡,有一半的普通民衆都含有對抗冠狀病毒的“記憶性免疫細胞(MT),現再加上積極的接種疫苗,新冠肺炎病毒的感染是不可怕的。在“記憶性免疫細胞”的監控下,只有那些産生輕微及溫和病變的病毒,與人類共存的可能性比較高,因爲這些病毒沒有進一步侵入人的下呼吸器官,即離開了人體再傳播,對人類沒有大害。只是那些比較惡性的病種,當它們還在人細胞內沒有成形前,即會被MT激活的CTL毀滅掉。在自然界的選擇與演化中,人類能具有非常珍貴的免疫系統;平時只要維持免疫功能的完整,人類必會擊敗所有病毒的侵害。惡劣致病的病毒必將自行消亡,只有溫柔的病毒才能與人類共存。H:人與病毒共生存的可能性Coexisting with SARS-CoV-2在七種感染人的冠狀病毒中,三種非常惡性,能感染下呼吸道器官(圖片4)造成嚴重肺炎及致命的疾病,新冠肺炎病毒就是其中之一。可是新冠肺炎病毒與其他兩種惡劣的冠狀病毒(SARS-1及MERS)有很大的不同點:新冠肺炎病毒突變得很快,似乎每一突變,病毒的感染力又增長到另一高坡。但是病毒的毒性相對上是保持不變,甚至反而有所下降,致死比率都是保持在2%左右。若仔細的觀察SARS與MARS兩種惡性病毒,它們的感染力相對上比較新冠病毒弱,可是造成嚴重肺炎及死亡率就很高;是13%及32%。SARS與MERS在疫情過後,似乎也就無聲無息再也不出現了。新冠肺炎病毒則隨著病毒的傳播與繁殖,不斷的産生突變,其感染力是每一突變比另一突變越來越強烈。可是因爲其感染,造成重症及死亡的百分比一般上還是保持不変(2%)。雖然現在有了全面性的接種疫苗,變種病毒的感染性還是很高,但是新冠病毒造成與接種疫苗者有關的死亡率似乎等于零。從種種現象來推測,新冠肺炎病毒的未來,不大可能會與SARS和MERS一樣一去不返。在沒有監控的情況下,新冠肺炎病毒還會繼續的突變,繼續的感染人類,但是因爲人們接種疫苗的普遍化,再加上自然免疫(尤其是細胞免疫)的提高,新冠肺炎病毒很難有可能感染到下呼吸道器官(圖片4),它將會與其他4種溫性的冠狀病毒相似,以感染人的上呼吸道器官爲主,成爲普通感冒病毒之一。結語曆史經驗告訴我們,人類文明社會的發展,從來都不是一帆風順的。自古以來,人類經曆了許多瘟疫,淘汰了無數生命。每一次瘟疫都對人類的生命、健康、財物,以及社會經濟造成巨大的威脅和破壞。但值得慶幸的是,人畢竟是“萬物之靈”,堅毅不屈,每當瘟疫降臨,都會從慘痛教訓中得到啓發,從而增長智慧。人總會不斷研制和開發對抗瘟疫的抗生素、藥物和疫苗,戰勝並預防瘟疫的重新出現。眼前全球疫情仍然嚴峻,然而,基于以下情況:1、新的以保護上呼吸道爲主的鼻腔粘膜疫苗(Intranasal Mucosal Vaccine),已成功研發;2、現有mRNA疫苗、rDNA疫苗,以及滅活疫苗都在不斷的改進;3、中國成功研發另一款新的mRNA疫苗,只需保存在攝氏2至8度,具有對抗新冠病毒導致死亡的功效,現已進入第三期臨床試驗。4、美國大藥廠Merck推出一款口服新藥Molnupiravir,能有效殺死早中期患者體內的新冠病毒,目前處于第二期臨床試驗之中,深受美國疾病控制與預防中心(CDC)和美國國立衛生研究院(NIH)的重視。疫苗的改進,新疫苗和新藥的推出,給我們以信心,烏雲終將散去,世界必定重現光明。(稿件內容及作者觀點僅代表個人,不代表本媒體立場,文責自負)
圖片16:源自 international autoimmune encephalitis society。人的免疫系統主要分爲B淋巴系統與T淋巴系統。當B淋細胞(右邊)受到抗原的剌激時,B淋巴球即變化成Plasma細胞,由此産生抗體。T淋巴系統可分化出CD8 CTL細胞,CTL可以直接殺死被病毒感染的細胞。T淋巴系統也分化出CD4淋巴細胞,CD4淋巴細胞分泌兩種Th-1與Th-2協調免疫功能的細胞因子,Th-1協調CTL功能,Th-2協調B細胞的抗體功能。受到病毒感染後,免疫系統都會有“記憶性的免疫細胞”(Memory B and Memory T lymphocytes)的産生。病愈後,MB和MT細胞還會遺留在免疫系統內。遺留在體內的MB和MT淋巴細胞是有不同的壽命;以2003年的SARS-1病毒爲例,SARS-1的MB細胞壽命比較短,可是MT細胞的壽命可達到12年以上。人若再次的受到同樣的病毒或者相似的病毒感染時,MB和MT都會分別被激活,同時也會大量的繁殖。激活了的MB會轉變爲血漿細胞(Plasma cell), 産生許多抗體(圖片16)。被激活了的MT也會大量的繁殖,生産出CD8 CTL (killer T)及CD4 T helper淋巴細胞(圖片16)。但是新冠肺炎病毒的感染,尤其是感染力很強的變種病毒(比如Alpha病毒與Delta病毒)都是由上呼吸器官開始,抗體(包括由接種目前的疫苗産生的抗體)及CTL在上呼吸道的防疫功能是非常衰弱的,不能控制病毒在上呼吸器官的感染及産生病變。只有當病毒往下呼吸道蔓延時,疫苗産生的抗體及CTL才能發揮作用,才能阻止病毒對下呼吸道的侵害及造成病變。這就說明了爲何新冠病毒在上呼吸道的感染力隨著突變越來越強,但是當病毒到下呼吸道,因爲有了接種疫苗引起的抗體及CTL的保護,病毒的毒性就起不了作用了。G1:現有的自然免疫 Existing Natural Immunity近期科學家Alba Grifoni et al等人,研討新冠肺炎病患者和健康人群免疫系統中的MT (對抗新冠肺炎病毒的記憶性丅細胞)含量,他們發現到受新冠肺炎病毒感染後,100%的患者血液中含有大量的MT (對抗病毒的記憶性丅細胞),同時他們也很驚奇的發現到有40%至60%的普通人(沒有受過新冠肺炎病毒的感染者)也含有抗新冠病毒的MT存在。這說明,普通人群可能是經常有接觸到普通感冒的冠狀病毒的感染,體內已經培養出許多能對抗新冠肺炎病毒的MT,MT隨時都能保護普通人群不受到病毒嚴重的傷害。類似的現象也在紐約觀察到;有40%的普通民衆有對抗病毒的MT細胞存在。連續的,約有34%, 28%及50%的普通人群,在德國、荷蘭及新加坡也有對抗新冠病毒的MT細胞的存在。在新加坡,有一半的普通民衆都含有對抗冠狀病毒的“記憶性免疫細胞(MT),現再加上積極的接種疫苗,新冠肺炎病毒的感染是不可怕的。在“記憶性免疫細胞”的監控下,只有那些産生輕微及溫和病變的病毒,與人類共存的可能性比較高,因爲這些病毒沒有進一步侵入人的下呼吸器官,即離開了人體再傳播,對人類沒有大害。只是那些比較惡性的病種,當它們還在人細胞內沒有成形前,即會被MT激活的CTL毀滅掉。在自然界的選擇與演化中,人類能具有非常珍貴的免疫系統;平時只要維持免疫功能的完整,人類必會擊敗所有病毒的侵害。惡劣致病的病毒必將自行消亡,只有溫柔的病毒才能與人類共存。H:人與病毒共生存的可能性Coexisting with SARS-CoV-2在七種感染人的冠狀病毒中,三種非常惡性,能感染下呼吸道器官(圖片4)造成嚴重肺炎及致命的疾病,新冠肺炎病毒就是其中之一。可是新冠肺炎病毒與其他兩種惡劣的冠狀病毒(SARS-1及MERS)有很大的不同點:新冠肺炎病毒突變得很快,似乎每一突變,病毒的感染力又增長到另一高坡。但是病毒的毒性相對上是保持不變,甚至反而有所下降,致死比率都是保持在2%左右。若仔細的觀察SARS與MARS兩種惡性病毒,它們的感染力相對上比較新冠病毒弱,可是造成嚴重肺炎及死亡率就很高;是13%及32%。SARS與MERS在疫情過後,似乎也就無聲無息再也不出現了。新冠肺炎病毒則隨著病毒的傳播與繁殖,不斷的産生突變,其感染力是每一突變比另一突變越來越強烈。可是因爲其感染,造成重症及死亡的百分比一般上還是保持不変(2%)。雖然現在有了全面性的接種疫苗,變種病毒的感染性還是很高,但是新冠病毒造成與接種疫苗者有關的死亡率似乎等于零。從種種現象來推測,新冠肺炎病毒的未來,不大可能會與SARS和MERS一樣一去不返。在沒有監控的情況下,新冠肺炎病毒還會繼續的突變,繼續的感染人類,但是因爲人們接種疫苗的普遍化,再加上自然免疫(尤其是細胞免疫)的提高,新冠肺炎病毒很難有可能感染到下呼吸道器官(圖片4),它將會與其他4種溫性的冠狀病毒相似,以感染人的上呼吸道器官爲主,成爲普通感冒病毒之一。結語曆史經驗告訴我們,人類文明社會的發展,從來都不是一帆風順的。自古以來,人類經曆了許多瘟疫,淘汰了無數生命。每一次瘟疫都對人類的生命、健康、財物,以及社會經濟造成巨大的威脅和破壞。但值得慶幸的是,人畢竟是“萬物之靈”,堅毅不屈,每當瘟疫降臨,都會從慘痛教訓中得到啓發,從而增長智慧。人總會不斷研制和開發對抗瘟疫的抗生素、藥物和疫苗,戰勝並預防瘟疫的重新出現。眼前全球疫情仍然嚴峻,然而,基于以下情況:1、新的以保護上呼吸道爲主的鼻腔粘膜疫苗(Intranasal Mucosal Vaccine),已成功研發;2、現有mRNA疫苗、rDNA疫苗,以及滅活疫苗都在不斷的改進;3、中國成功研發另一款新的mRNA疫苗,只需保存在攝氏2至8度,具有對抗新冠病毒導致死亡的功效,現已進入第三期臨床試驗。4、美國大藥廠Merck推出一款口服新藥Molnupiravir,能有效殺死早中期患者體內的新冠病毒,目前處于第二期臨床試驗之中,深受美國疾病控制與預防中心(CDC)和美國國立衛生研究院(NIH)的重視。疫苗的改進,新疫苗和新藥的推出,給我們以信心,烏雲終將散去,世界必定重現光明。(稿件內容及作者觀點僅代表個人,不代表本媒體立場,文責自負)
本文刊載于《怡和世紀》2021年10月第45期。
作者爲《怡和世紀》編委謝華謙, 爲加拿大華裔資深微生物醫學博士

《怡和世紀》是新加坡百年曆史的華人俱樂部怡和軒所出版發行的綜合雜志,含時事觀點、金融財經、人文史地,也設有藝文欄目,是本地文化圈的心血之作。
《怡和世紀》已辦刊十年,現推出珍藏版合集(12期到44期)共33本,僅售10套,每套售價260新幣。也歡迎訂閱新刊,每年3期,單本訂閱價格10新幣,全年訂閱(3期)24新幣。有興趣的讀者可以聯系《怡和世紀》發行部門,亦歡迎海外訂閱。
詳情請電郵垂詢:[email protected]
網站:www.eehoehean.org
官網:www.yiheshiji.com
<新加坡眼粉絲福利>
在新加坡眼APP上,僅需20金幣即可兌換《怡和世紀》雜志珍藏版一期,點擊這裏,即可兌換。