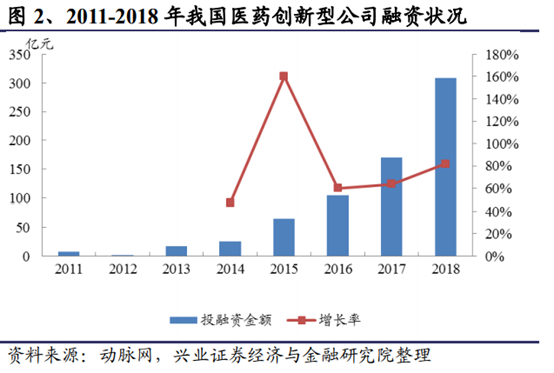
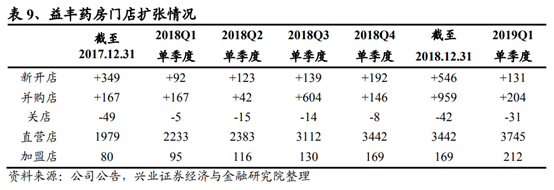
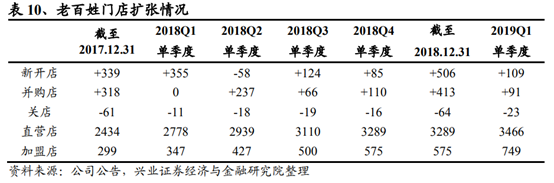
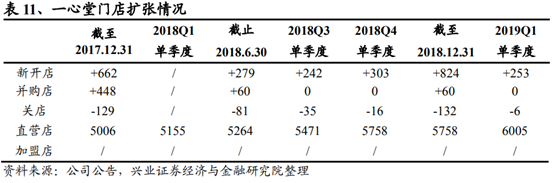
(溫馨提示:文末有下載方式)
第一篇:新機構、新環境、新做法
1.1、新的機構和任務
新機構
近年來,在政策驅動下醫藥行業處于深刻變革進程中。一方面,在醫保控費大背景下,二次議價、帶量采購等帶來的藥品價格壓力仍在,醫藥行業進入整體增速放緩的新常態。雖然行業性高速增長階段不複,但在人口老齡化加速下行業需求依然穩定,醫藥行業長期保持穩定增長依然可期。另一方面,近年來一批重要的綱領性政策文件出台,匹配細則陸續發布,醫保談判目錄、一致性評價、優先審評、創新藥等重要改革成果陸續進入收獲期,行業內結構性機會凸顯。在行業平穩增長,政策壓力猶在,重要改革成果陸續落地的背景下,行業和企業格局正在發生新的變化,這些變革也將爲後續醫藥行業的投資醞釀出新的機遇和選擇。
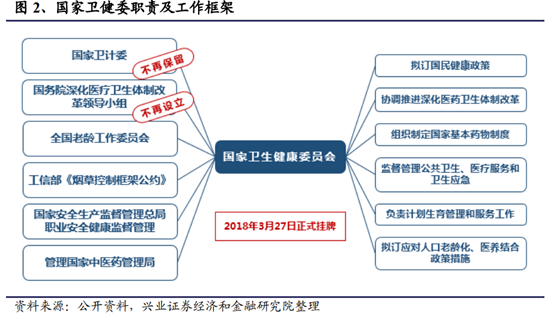
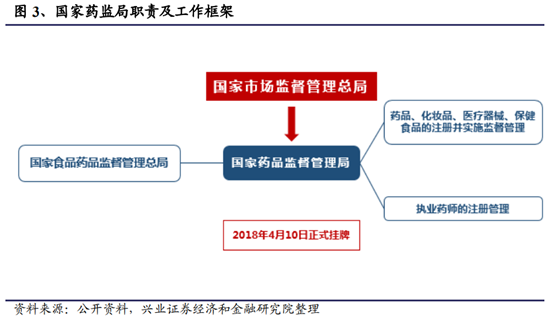
2018年3月13日,第十三屆全國人民代表大會第一次會議審議國務院總理提請的國務院機構改革方案的議案。改革後,除國務院辦公廳外,國務院下設26個部門。其中三大部門改革牽涉醫藥行業未來走向:組建國家醫療保障局;組建國家衛生健康委員會;組建國家藥品監督管理局,由國家市場監督管理總局管理。此番改革旨在提高醫療保障水平,合理使用醫保資金;深化公立醫院綜合改革,提高醫療衛生服務質量,解決群衆看病難的問題,以治病爲中心轉向維護全民健康;進一步深化藥品醫療器械審批審評制度改革,並加強藥品、醫療器械和化妝品生産、流通和使用環節監管。從醫藥商品及服務的市場准入,到醫院供應,到最終付費買單,提供全方位國家政策層面上的支持引導。
新任務
此次機構改革,是進一步深化“三醫聯動”的重要措施,醫保局、衛健委、藥監局三個新機構分管醫保、醫療、醫藥,明確各自職能,提升效率。醫保局主要負責醫保收支,其職責爲:擬訂醫療保險、生育保險、醫療救助等醫療保障制度的政策、規劃、標准並組織實施,監督管理相關醫療保障基金,完善國家異地就醫管理和費用結算平台,組織制定和調整藥品、醫療服務價格和收費標准,制定藥品和醫用耗材的招標采購政策並監督實施,監督管理納入醫保範圍內的醫療機構相關服務行爲和醫療費用等。同時,城鎮職工基本醫療保險、城鎮居民基本醫療保險、新型農村合作醫療均交由醫保局統一負責管理,促進“三保合一”的推進。衛健委移交招標權限,未來更多專注于醫院相關事務和臨床規則的制定,其職責爲:擬訂國民健康政策,協調推進深化醫藥衛生體制改革,組織制定國家基本藥物制度,監督管理公共衛生、醫療服務、衛生應急,負責計劃生育管理和服務工作,擬訂應對人口老齡化、醫養結合政策措施等。藥監局仍主要負責質量控制,下屬于國家市場監督管理總局,其職責爲:藥品、化妝品、醫療器械、保健食品的注冊並實施監督管理,以及對執業藥師的注冊管理。從三個機構改革成立後出台的政策可見,各部門各司其職,紛紛出台推動醫藥行業改革的重要政策,例如醫保局推出的“藥品集中采購試點”和“2019年醫保目錄調整方案”、以及衛健委擬推進的“全國輔助用藥目錄”等等。
此次機構改革中,國務院不再設置深化醫藥衛生體制改革領導小組辦公室,體現出我國醫改已經進入新的階段,大致方針路線已經明確,只待後續不斷推進和深化。
醫藥:藥監局政策框架已定,後面就是執行問題
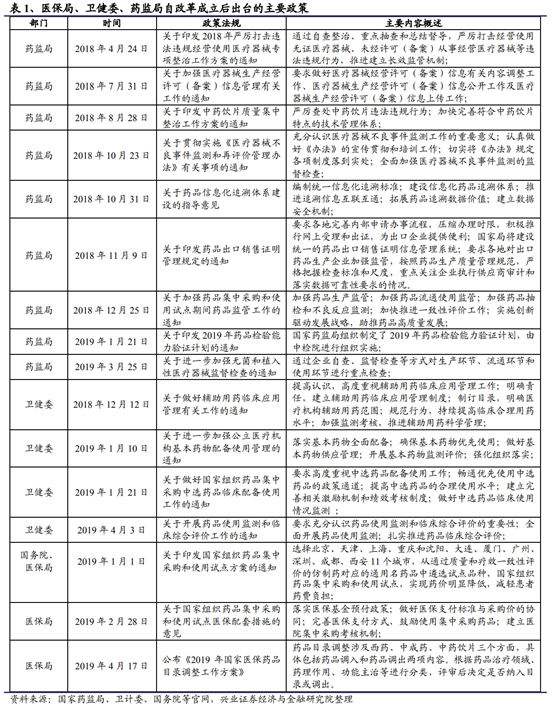
雖然2018年由于某些行業事件的影響,部分藥監系統人員發生變動。但從長期來看,藥政改革大方向不會發生變化。衆所周知,近年來藥監系統已經推出了一系列大力度的改革政策——無論是清理申報積壓、規範臨床數據這些清理積弊的工作;還是飛行檢查、臨床核查、一致性評價等保證藥品質量的工作;亦或是優先審批、加入ICH等鼓勵創新、接軌國際的政策。這些政策要麽已經取得了明顯的成效(如目前申報排隊的情況已基本得到解決,臨床試驗數據質量明顯提高等),要麽正在逐步推進過程中(如一致性評價)——政策“框架”已經搭好,改革也已在路上,政策的延續性是可以預期的。
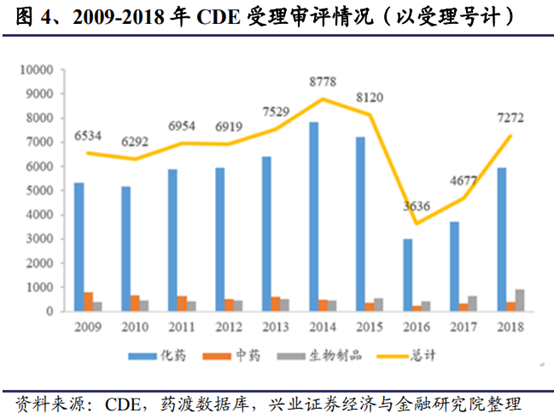
從2018年的結果來看,藥監局碩果累累,在經曆機構調整和人事變動後各項事務仍穩步推進。在清理申報積壓和推進優先審批等措施下,無論是受理審評情況還是創新藥批准上市情況均有較爲明顯的提升。在仿制藥領域,基于一致性評價工作的良好進展,國務院推進“帶量采購”(即藥品集中采購),引導新一輪産業升級。當前,一致性評價的“熱情”不減,隨著新一批通過一致性評價的品種誕生,我們預計第二批帶量采購已愈行愈近。
醫保:帶量采購持續推進,“兩壓一保”結構性機遇猶存
醫保局的成立結束我國醫保支付與醫藥定價的碎片管理。作爲新成立的國務院直屬機構,國家醫療保障局對此前四個機構的相關職責進行重新整合,包括:1)人社部的城鎮職工和城鎮居民基本醫療保險、生育保險職責;2)衛計委的新型農村合作醫療職責;3)國家發改委的藥品和醫療服務價格管理職責;4)民政部的醫療救助職責。我們認爲,醫療保障局的設立將支付、定價相關的職能集中于一體,一方面從管理職能上解決了長期存在的九龍治水狀態,整合後各個職能有望進一步發揮協同效應,另一方面爲醫藥、醫療、醫保下一步的支付與定價相關制度改革帶來良好環境。
國家醫保局把三者化爲一體,將統一組織制定和調整醫療服務、醫藥産品的收費標准和價格,具有市場流通以及銷售最終價格的決定權,各職能可發揮較好的協同作用,未來控費力度可能繼續加大:1)價格制定領域,藥品經濟學要求將逐漸提高,未來醫療服務與醫藥産品(藥品、器械、耗材)的價格將以實際相對于已有産品新增的臨床價值而定;2)招標采購領域,各地招標頻率有望提升,經過質量與療效驗證的通過一致性評價的仿制藥和質量技術過硬的國産器械、耗材産品將獲得原研替代加速放量機遇。醫保部門將從被動的支付者逐步走向前台,逐步主導醫藥器械等品種的采購。
● 新的采購模式值得關注,但全面實施需要較長時間。處方藥企的生命力在于新品種,除部分壓價矯枉過正的低價藥和血制品産品外,大部分處方藥上市後基本不會提價。對標雙信封模式全國推廣,預計新的帶量采購模式將循序漸進,期間難仿藥、創新藥已經大量上市,有能力對沖仿制藥價格端的壓力。其次,首批試點地區主要爲發達城市,全面滲透存在一定難度。目前通過一致性評價的品種尚不多,帶量采購對于上市醫藥企業短期的業績影響有限。
● “帶量采購”與“雙信封”模式對企業的影響異同:從市場增量比較,帶量采購明確保證了中標産品大比例的市場采購量。從出廠口徑真實降價來看,帶量采購降價可通過銷售費用、二次議價空間壓縮、回款賬期縮減等進行部分彌補,真實價格的下降實際上比中標價格降幅小。可充分競爭的品種降價主旋律不變,受益品種始終爲競爭格局好國內企業市占率又有提升空間的産品。
未來醫藥行業結構性分化將是長期趨勢,輔助用藥和安全性、有效性存疑的大品種將進一步承壓,而臨床效果明確的治療性産品、滿足臨床實際需求的創新産品、質量療效安全可控的進口替代産品和物美價廉的低價藥産品將獲得市場發展良機:
1)臨床效果明確産品治療屬性強,招標降價壓力較小,醫保限制可能性較小;
2)創新藥産品在自主定價上具備優勢,上市後可及時通過招標采購打開市場,後續有望通過動態國家醫保目錄談判調整進入醫保報銷體系,開啓新放量周期;
3)通過一致性評價的仿制藥視作與原研藥具備同等療效與質量水平,招標評分層次的調整和地區級挂網銷售處理將繼續提速進口替代進程;
4)常用低價藥品降價空間不大,新招標政策下不參加招標直接挂網采購,反而有一定提價可能性。
醫療:逐步進入深水區,臨床路徑、分級診療陸續推進
過去幾年中,公立醫院改革雖然在有序推進(比如取消了公立醫院藥品加成、開始推廣分級診療、家庭醫生等),但仍有很多工作需要深入開展,國家衛生健康委員會在公立醫院改革這一深水區方面承擔著非常重要的使命。
我們推測,一方面目前正在積極推廣開展的臨床路徑推廣將得到加速實施,各類疾病的治療指南將得到強化,未來對醫院的診療流程也將變得更加規範化。這可能會對目前藥企的營銷方式帶來新的沖擊,除了既有的銷售模式之外,如何能夠更好對KOL(一般是各治療領域的主委專家)施加學術影響,更好的展示産品的獨特性,將成爲企業新的課題。而無法進入指南的一些産品或將逐步轉戰院外市場,爲藥店和基層渠道帶來新的品種。
另一方面,分級診療和家庭醫生制度也或將得到更快的發展,高等級醫院將更多的成爲疑難雜症的治療中心,基層醫療機構及二級醫院或將成爲更多民衆首診的地點。隨著醫生多點執業的逐步放開和高端民營醫療機構的發展,部分高收入階層的醫療需求可能將向高端民營醫療機構轉化。
1.2、醫保收支的新環境
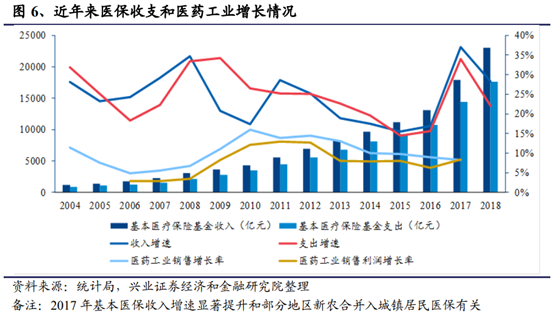
老齡化程度的加深將對國內經濟、社會的發展産生極其深遠的影響。從主要矛盾來看,老齡化程度加快將帶來醫療需求的增加,我國醫保基金支出壓力將持續加大。一方面,隨著老齡化程度不斷加深,醫保基金“收少支多”漸成常態。截至2018年末,我國醫療保險參保人數已達13.4億,基金累計結存2.3萬億。從醫保基金的收支情況來看,雖然累計結存超過2.3萬億,但2018年醫保基金的支出增速仍大于收入增速近3個百分點,全年基金支出達1.76萬億,醫保基金仍面臨著較大的可持續壓力。另一方面,雖然整體結余,但各地存在著不平衡的情況。據統計,2017年職工醫保統籌基金和城鄉居民醫保基金分別有一些統籌地區出現當期赤字,個別統籌地區甚至出現曆年累計赤字。此外,個人賬戶的余額沉澱也是一大問題。
從國內醫藥行業的發展曆程來看,行業增速和醫保收支的增速密切相關:從2004年至今,醫藥行業先後經曆了醫保擴容帶來行業高速增長階段、行業政策多空交織下的行業降速階段以及當下醫保控費進一步趨嚴帶來的行業分化階段。後續我們預計隨著醫保資金壓力漸顯,醫保部門對于行業政策的制定影響程度日益加深,控費更加科學化和精細化,行業內企業必將面臨著持續的壓力和分化,同時對于後續産品儲備豐富、可以滿足未滿足的臨床需求的産品仍將受到患者和支付方的青睐。
1.3、綜合性的深度醫改箭在弦上
中國的醫療體系改革是高度複雜的系統性工程,由于各地經濟發展水平、醫療發展水平等存在高度的差異,單一的模式未必具有普適性。從此前發源于地方後續又被其它地區推廣借鑒的安徽模式、三明模式來看,其在推廣過程當中都經曆了較大幅度的改良和溫和化的處理,後續若源于上海的帶量采購向全國大範圍推廣,我們預計仍將經曆一定範圍內的試點和政策調整。
從安徽模式的變遷看藥品集采方式的變革
醫保局當前推廣的帶量采購模式,是我國首次以國家名義組織的藥品集中采購試點,其方向對未來全國藥品招采模式演變的指引作用不言而喻。然而此次帶量采購(即之前的“上海模式”)的推廣,也並不是我們第一次推廣地方具特色的招標模式。
回望上一個全國廣泛推廣的藥品集采模式——以安徽爲代表的“雙信封”模式,其如今已成爲全國範圍各省級平台藥品集中采購的核心基礎。我們以雙信封模式在國內全面推開的發展角度來分析“帶量采購”模式的發展軌迹。藥品采購中的安徽模式其最典型的特點即爲“雙信封”招標和“唯低價是取”的采購形式和中標原則。表面上看安徽模式考慮到了藥品的質量和價格因素,但在實際的執行過程當中,由于國內的仿制藥企的管理和藥品質量確實存在一定的差異,在最低價中標的規則之下,藥品的質量和供應如何保證成爲影響藥品使用和采購中始終無法解決的難題,也影響了醫療服務的質量。因此,隨著時間的推移,經過改良的雙信封模式僅在競爭廠家較多、臨床需求量比較大的品種采購當中得以保留,部分地區對于産品質量的要求有所強化,後續分類采購等招標形式更全面的滿足了臨床的采購用藥需求,成爲當下主流的方案。
從曆史經驗來看,醫改試點政策在全國範圍推行之前需要經過反複調整修正,11個城市的帶量采購模式雖然已經開始執行,但後續全國推廣的不確定因素依然較多,尚無法預估未來執行力度。可以想見,未來如果“帶量采購”得以大範圍推廣,也將是一個配合一致性評價,較爲漫長的過程,全面推開可能需要幾年的時間。在這期間,優秀的龍頭企業産品結構早已發生變化,難仿藥、創新藥已經大量上市,有能力對沖仿制藥價格端的壓力。再者,當前的試點地區主要爲發達城市,全面滲透存在一定難度。此前雙信封推廣是以省級地區爲單位逐步推廣,而帶量采購模式優先選取4直轄市+7重點城市作爲試點,廣泛覆蓋全國主要片區。由此推導,未來帶量采購模式的推廣將采取先大城市後中小城市及基層方式。單從醫保預付角度來看,醫保資金統籌與結余程度在各個地區也存在差異。預計新模式總體追求平穩過渡、妥善銜接,不會一蹴而就。
從短期來看,帶量采購利好部分品種的進口替代,但長期來看,所有仿制藥的産品價格都會逐步下降。一部分國産企業如果有品種能夠率先通過一致性評價,且該品種外資産品占比比較大的,則其可能階段性受益。而從長期來看,質量、價格、品種線的豐富度是決定企業競爭力的核心,任何單一品種依賴的仿制藥企業都將面臨長期壓力,品種豐富價格合理的企業會長期勝出。
醫療器械領域即將迎來變革
● 醫療器械行業“兩票制”的影響
截至2019年5月,31個省市中已有21個省市出台醫療器械“兩票制”的相關文件,明確指出將開展醫用耗材的“兩票制”工作。參考藥品行業兩票制政策的落地過程,醫療器械行業兩票制在全國的實施將遵循“試點-複制”的模式。鑒于醫療器械的産品種類多,不同産品的經銷模式複雜,預計醫療器械行業兩票制政策的實施會比藥品行業用時更長,但醫療器械“兩票制”模式的全國落實確實是大勢所趨。
兩票制的目的在于減少中間流通環節,壓縮灰色地帶,在實際操作中將對行業的營銷模式、營銷渠道産生巨大的影響。
1)營銷模式改變:兩票制將對行業財稅處理方式進行改革。原來行業內廠商多采用底價代理模式,不涉及財稅問題,兩票制施行後,財稅問題將無法再交由代理商處理。生産企業只能采用高開發票,再通過傭金等方式返利給經銷商。因此,兩票制增加了生産企業的稅務處理成本。同時,壓縮中間環節後,生産企業將承擔部分營銷與市場推廣的負擔,企業的運營成本提升。
2)市場集中度提升:隨著稅務處理和運營成本加大,小規模、低利潤的産品將被市場淘汰。因此,爲了降低成本,追求規模效應,兩票制將變相加速醫療器械行業並購重組,市場資源向大型企業傾斜,市場集中度提升。
3)渠道要素變革:兩票制推行後,只能通過提高産品銷售價格來轉嫁稅務成本和運營成本,以過票爲生的流通商業的利潤空間將被嚴重擠壓,並迫使他們成爲生産企業的一級經銷商。一級經銷商數量大幅上升將使得渠道寬度增加,經銷難度加大,物流、票流、信息流、資金流都將發生變化。
● 集采降價將可能來臨
2015年衛計委發布《關于落實完善公立醫院藥品集中采購工作指導意見的通知》,涉及分類采購、改進結算方式、加強配送管理、規範采購平台建設、對耗材進行成本效益評估等細化准則,奠定了國家在新階段對耗材集采要求趨嚴,逐漸與藥品同標准的趨勢。
截至2018年3月15日,我國31個省份中有29個省已經啓動了高值醫用耗材十大類的省級集中采購;14個省啓動了低值醫用耗材的省級集中采購;10個省啓動了對檢驗試劑的省級集中采購。而在地級市範圍,耗材集中采購的執行情況則受到政策變動等影響,尚處于初級階段,推廣率較低。總體來看,耗材集中采購尚且停留于部分城市,在全國範圍的滲透深度不夠,涉及的耗材種類多集中于高值耗材,其余種類的覆蓋度不高。
在醫保控費等因素影響下,國家十分鼓勵集采模式的創新以減輕醫保壓力。例如在國務院印發的《“十三五”深化醫藥衛生體制改革規劃》中明確提出“在高值耗材集采方面,要求區別不同情況推行招標采購、談判采購、直接挂網采購等方式”。目前,各省市已經根據自身經濟環境、醫療需求等探索出多種集采模式。
下半年政策擾動大于上半年,但醫改大方向不變
進入6月份,醫改重磅政策開始密集出台,6月4日,財政部網站公布根據2019年度財政督查檢查計劃,決定開展醫藥行業會計信息質量檢查工作。5月14日,財政部監督評價局會同國家醫療保障局基金監管司,共同抽取了77戶醫藥企業檢查名單。
另一個引起投資人關注的政策表述來自國辦【2019】28號文——深化醫改2019年重點工作任務的通知,其中提到制定改進職工醫保個人賬戶政策文件(國家醫保局負責,2019年12月底前完成),結合近期已經啓動的城鎮居民醫保賬戶改革,導致部分投資人認爲該政策會對藥店使用醫保資金帶來較大的壓力,從而導致了藥店板塊的回調。
關于財政部會計核查,我們認爲首先需要認識到這是依據《中華人民共和國會計法》等法律法規和每年年度財政督查檢查計劃開展的常規工作。同時我們也要注意到,今年以來,醫藥行業的確出台了較多新政策、也出現了部分公司的財務會計問題,引起社會輿論的關注。
我們認爲,以當下的全行業情況來看,醫藥領域的營銷費用確實還存在著一些不規範的現象,但大部分公司(特別是大型制藥企業)較之多年前的財務規範度已經有了明顯提高,營銷推廣的方式也已經發生很大變化(臨床科研項目、科室會、論壇等學術推廣正在成爲主要的推廣方式)。短期來看我們認爲此次核查對企業的營銷行爲或有階段性影響,但從當下文件的表述來看在全行業核查全面推廣的概率也不高,且前期下跌的標的中有多家未出現在77家企業名單中或其主業並不具有高比例的銷售費用支出,我們建議投資人還是應當甄別具體情況,優選被錯殺的品種。
而由于城鎮職工個人賬戶牽涉面廣,體量龐大,各地情況不一,預計職工個人醫保賬戶的改革會逐步推進(例如進行增量改革、設置較長時間的過渡期等),短期對于藥店行業的影響可控。
長期來看會利于藥店行業的專業化能力提升和處方外流。個人賬戶的改革預計與社會藥店對接門診統籌賬戶的改革相輔相成,如果社會藥店對接門診統籌賬戶,醫保對藥店的醫保支付管控會更加嚴格,這對藥店轉型、提供專業價值服務等提出新的要求,我們認爲專業化服務能力強的藥店更有可能在行業變革中勝出。此外如果藥店對接門診統籌賬戶,藥店會與醫院享受類似的報銷條件,疊加醫院藥品集中采購、醫院藥品零差率等降價政策,有望促進處方藥流向零售端。
我們認爲,考慮到今年年內醫保目錄還將做出進一步調整,新一輪的醫保談判也將開啓,更多優質、具創新性的藥品將會進入醫保目錄,我們認爲醫保投入的長期增加趨勢並未改變,各項相關政策的出台(無論是4+7的推廣、第二批帶量采購、還是醫保目錄調整,個人賬戶的改革)都旨在調整醫保用藥結構、提高資金使用效率。所以,下半年雖然進入了政策密集期,但醫改的長期政策趨勢依然不變。
第二篇、仿制藥:帶量采購後的仿制藥轉型
2.1、仿制藥企:超額利潤逐步被壓縮,定價和銷售模式長期面臨重塑
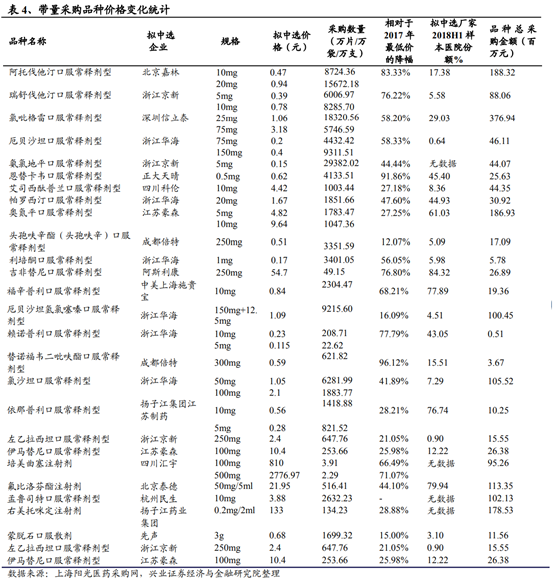
2018年12月,業內關注的4+7藥品帶量采購預中標結果發布。根據采購預中標結果來看,整體價格較2017年最低價降幅約52%,藥價水平顯著降低。本次的采購方案經過深改委討論,是最高層對藥品采購做的“頂層設計”。其政策核心包括:1.單一貨源中標;2.最低價中標;3.配合一致性評價推進。從價格層面來看,本次帶量采購同品種報價最低的企業獲得預中選資格,然後進入議價談判確認程序,根據同品種不同企業的數量以最低報價(3家及以上/不多于2家但降幅排名前列)或者在最低報價基礎之上再進行一定的議價降幅(不多于2家企業)確定擬中標資格。整體來看,有6個品種因爲未能確定最終價格而流標。本次帶量采購擬中標的企業之中國內企業占92%(僅吉非替尼和福辛普利由外資企業中標,且價格較周邊國家和地區低25%以上),本次帶量采購的平均降幅(相對于2017年試點地區有參考數據的最低價)約爲52%,降幅最大的品種達96%,參與競標的國內企業數在3家及以上的品種平均降幅爲57%,參與競標的國內企業數爲2家和1家的降幅分別爲49%和29%。整體來看,多數品種的藥價水平較之前顯著降低,有望進一步節省患者的用藥負擔和醫保費用的支出。
此次帶量采購改變了此前藥品采購受诟病較多的招采分離、量價脫鈎的的影響。量價挂鈎的背景之下試點品種的價格預計普遍較現有的中標價格有所下調。本質上是在質量有保證的品種(未來可能是通過一致性評價的品種)中選擇價格最低者,給予其最大的市場份額。帶量采購之後,醫保部門通過醫保額度、定期核查等方式保證帶量采購品種的使用,從而使得之前藥企爲了推廣仿制藥品種産生的大量的銷售費用得以節約。當然,相比于價格的下降,銷售費用的降低具備滯後性,也將是一個長期的過程。此外,醫保/醫院部門對醫院的結算從數月甚至更長時間的的賬期到提前預付,也將減輕企業的財務費用率。
業績影響可控,估值沖擊值得關注
在業績方面,此次帶量采購對醫藥行業業績影響相當有限(特別是對于2019年):首先,雖然此次采購的降幅不低,但從實施的範圍來看,這次試點31個品種在整個醫藥市場來說不是很大。同時這次是一致性評價作爲帶量采購的前提,目前,289個基藥目錄口服制劑的一致性評價還遠沒有完成,可以想象包括口服的非基藥及注射劑再評價可能需要4-5年時間。這個時間能夠給予最夠優秀的上市公司來完成難仿藥、創新藥轉型升級,對業績影響很可控。
此外,對中標企業來說,帶量采購還是有很多騰挪空間的:對中標的企業,其能夠提升市場份額的,銷售費用率也會出現比較大的下降,且外資在這些品種上原本還占有較大的市場空間(樣本醫院數據外資市占率還在50%左右),而這次帶量采購92%的品種由內資企業中標,可見進口替代的空間還比較大。
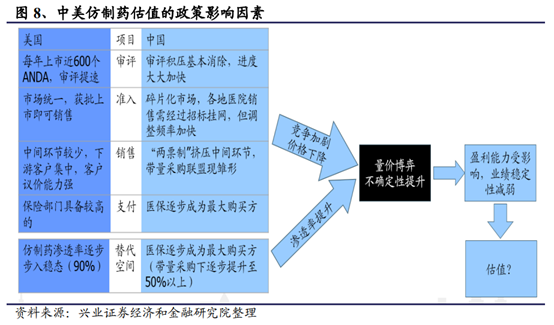
但另一方面,帶量采購對于仿制藥板塊估值的長期影響確實值得關注。由于此次帶量采購的降幅較大、超出市場此前預期,且價格公開可查詢,那麽其他省份是否會采取“價格聯動”,從而形成全國範圍內的相關品種降價值得我們關注。從國際比較的角度來看,此前國內仿制藥企業較海外藥企具備超額利潤,後續受帶量采購等政策的影響估值溢價和業績確定性逐步降低。此前國內企業在競爭格局、盈利能力和業績的持續性上較美國仿制藥企業具備優勢,也帶來了一定的估值溢價。但在帶量采購之下,長期來看競爭加劇和采購降價導致國內仿制藥企業面臨的市場環境不確定性增加,後續超額利潤和估值溢價或將逐步消失。
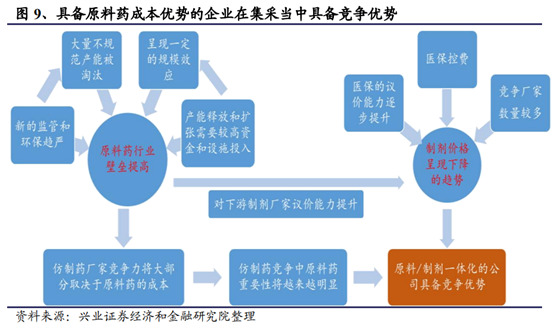
而且,隨著帶量采購政策的落地和後續逐步的推廣,政策方向已經明確了將壓低過期原研藥和國內高價仿制藥的價格,以使得醫保覆蓋更多的品種,覆蓋更多的人群。可以預期,隨著一致性評價通過的品種越來越多,帶量采購的價格會逐步循環式向下,仿制藥的超額利潤會被逐步擠壓,長期來看,仿制藥的“超額利潤”將逐步消失。因此此次帶量采購對仿制藥企業的估值體系確實會産生一定沖擊。但大型仿制藥企業依然具備一定的騰挪空間,費用率的變化也可部分緩沖價格端所受的沖擊。上遊原料藥企業的議價能力將逐步提升,具備原料藥/制劑一體化的公司也將在後續的成本競爭當中獲得優勢。未來國內優質的仿制藥公司通過後續産品梯隊特別是創新藥品種上市依然可以實現公司的轉型升級和業績的持續發展。
2.2、從海外經驗看仿制藥企的轉型升級路徑
帶量采購的新形勢下,從短期來看帶量采購利好部分品種的進口替代,但長期來看所有仿制藥的産品價格都會逐步下降。如果部分國産企業的品種能夠率先通過一致性評價且該品種外資占比較大,則其可能階段性受益。但由于一致性評價會持續進行,通過的廠家也會增加,對于有利可圖的仿制藥品種勢必會有企業謀求以價換量。仿制藥品種後續將更加普遍的面臨量價的博弈,企業業績增長的確定性和仿制藥的利潤水平將會受到影響,進而影響到投資者對于仿制藥企的估值水平的判斷,政策之下也會倒逼企業加大創新轉型、營銷模式轉變和推進一致性評價的進度。
轉型創新:
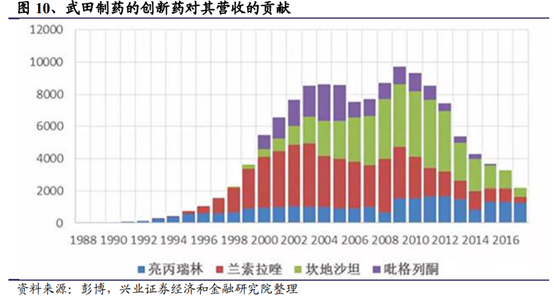
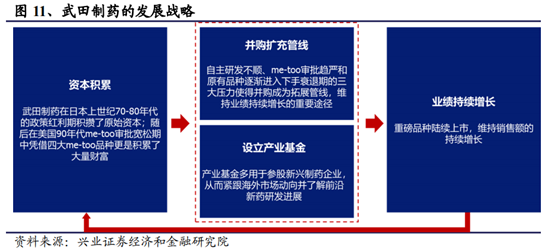
這是最優選,同時也是一條最具挑戰性的道路,在海外其最著名的例子便是日本的武田制藥。從背景來看,日本在上世紀70年代中期之後,隨著經濟增速和財政收入的下滑,醫保覆蓋率的提升和人口老齡化帶來的醫保支出的壓力也逐步增大,控費的壓力直接影響到醫藥工業整體的運行,與我國當前醫藥行業面臨的形勢極爲相似。在日本國內市場傳統品種面臨醫保控費和降價的壓力下,一批企業轉向“創新+國際化”,武田、大冢、第一三共、衛材、安斯泰來等一批如今日本的國際巨頭也都在那時崛起。武田從仿制走向創新,成功研發亮丙瑞林緩釋微球、蘭索拉唑、吡格列酮等産品並走向國際市場。
這條道路需要企業有較大的規模和大量的研發投入。此外,我們認爲企業研發的基因需要較長時間打造,今天再去轉型創新或已爲時過晚,因此我們更加關注那些已經在大量投入研發,擁有一些II、III期臨床管線的企業。
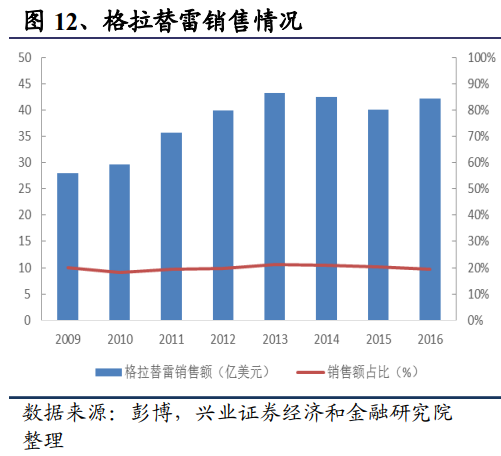
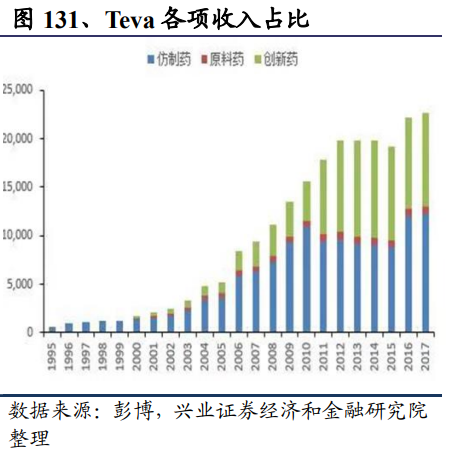
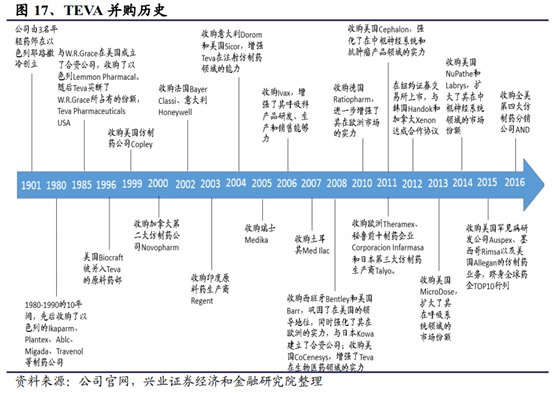
另外以仿制藥巨頭Teva爲例,盡管其是最大的仿制藥企業,但在收購ActavisGenerics之前,其創新藥部門實力也較爲雄厚,專科藥收入與仿制藥營收差距微弱。2012年專科藥收入達80億美元,2016年則增加到86億美元。其核心品種Copaxone作爲一種孤兒藥(OrphanDrug),獲得了美國7年數據保護時間,2012-2016年格拉替雷的銷售額均超過40億美元,連續多年位居全球暢銷藥物前20。Teva的專科藥收入甚至可以排進制藥巨頭前三十強。盈利方面,創新藥部門是Teva的主要利潤來源,2012-2017年間,平均每年奉獻盈利達44.9億美元,占公司總盈利的53.7%以上;而相比之下,仿制藥部門只有25.3億美元,僅占公司總盈利的23.5%。
打造難仿藥
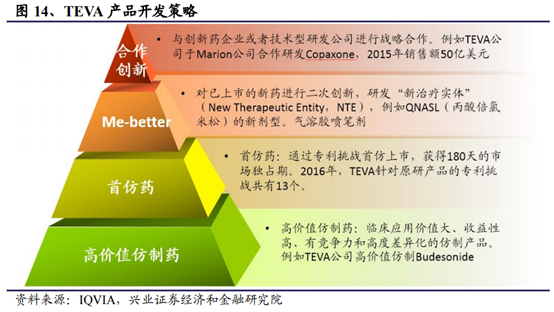
從海外仿制藥巨頭的營收上來看,雖然多數仿制藥公司的營收構成以仿制藥爲主,但其利潤來源卻以多數難仿藥或者創新藥爲主。面對仿制藥領域日趨激烈的競爭,部分仿制藥巨頭也依托自己在工藝和劑型等方面的優勢布局創新藥。當然,由于和傳統的跨國藥企在基礎研發方面還有一定差距,對于仿制藥龍頭企業來說,一般具備相對不錯的現金流和資金水平,通過並購來獲得一些高壁壘的品種的技術也不失爲一種進度較快、切實可行的手段。在這之中以Teva布局較早成果落地和給公司業績表現帶來的提升作用也更加明顯。總結TEVA的研發策略,可分爲四種研發方向“高價值仿制藥”、“首仿藥”、“NTE(NewTherapeuticEntity)”、“合作創新”。
通過劑型創新、工藝創新、藥品-器械複合體打造出壁壘的企業,這方面比較典型的例子是美國Mylan(其主打産品腎上腺素注射筆Epipen雖然藥品是老品種,但通過藥品-器械聯用也打造出了10億美金以上的重磅品種)。由此可見,仿制藥並非沒有壁壘,即使藥品過了專利期,也可以通過多種方式保持其市場獨占性。從部分美國仿制藥巨頭銷售額居前的品種當中,也可以看到,多數品種爲原研(部分通過收購獲得)或者首仿等壁壘較高的品種。
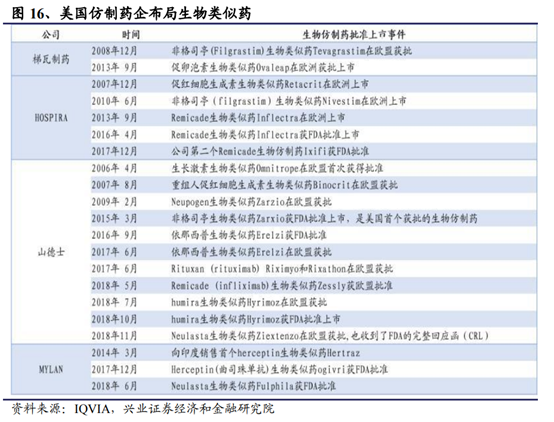
除此之外,由于和化學仿制藥相比,生物仿制藥具備競爭壁壘較高、競爭格局較好和盈利水平較強的特點,多數海外仿制藥巨頭也陸續切入生物仿制藥領域。
做長産品線+走向國際化:
由于産品線相對比較單一的公司業績出現波動的概率更大,爲了緩和業績的波動和擴大産品線,通過並購擴充産品線往往成爲仿制藥公司提升市場份額和走向國際化的的重要手段。但並購之後的整合也往往面臨一定的問題甚至拖累公司的業績。這樣的例子在海外較多,比較典型的同樣是Teva。
整體來看,仿制藥在一致性評價和帶量采購帶來的去産能的背景之下品種面臨分化,但大型仿制藥企業依然具備一定的騰挪空間,費用率的變化也可部分緩沖價格端所受的沖擊。上遊原料藥企業的議價能力將逐步提升,具備原料藥/制劑一體化的公司也將在後續的成本競爭當中獲得優勢。長期來看,質量、價格、品種線的豐富度是決定企業競爭力的核心,任何單一品種依賴的仿制藥企業都將面臨長期壓力,品種豐富價格合理的企業會仍然長期勝出。後續儲備品種較多且有能力通過一致性評價,且願意以降價換取市場的企業有望成爲新的招采規則下的受益者。未來國內優質的仿制藥公司通過後續産品梯隊特別是創新藥品種上市依然可以實現公司的轉型升級和業績的持續發展。
第三篇、創新藥:政策和資本紅利助推成果落地,關注行業新變局
3.1、政策和資本紅利助推成果落地
● 正式成爲ICH管理委員會成員,加速接軌國際
2017年6月19日下午4時,國家食品藥品監督管理總局(CFDA)召開新聞發布會宣布正式加入ICH,即國際人用藥品注冊技術協調會。2018年國家藥品監督管理局當選爲ICH管理委員會成員。ICH是國際藥政監管部門和産業界合作的結果,通過協調各國藥物注冊技術要求,包括統一標准、檢測要求、數據收集及報告格式,使藥物生産廠家能夠應用統一的注冊資料規範,按照ICH的有效性、質量、安全性及綜合學科指南申報。在統一指導原則下,制藥企業可以在各成員國同時上市其産品,提高申報注冊資料的質量,同時縮短研發時間,節省研發成本,提高藥物研發、注冊、上市的效率。加入ICH,意味著中國的藥品監管部門、制藥行業和研發機構將逐步轉化和實施國際最高技術標准和指南,並積極參與規則制定。同時提升國內制藥産業創新能力和國際競爭力。通過實施ICH指導原則,也會加深中國制藥企業對藥品注冊國際技術要求的理解,提高國際注冊的成功率。這是藥品注冊領域真正的與國際接軌,將推動國際創新藥品早日進入中國市場,滿足臨床用藥需求但這同時也意味著中國醫藥産業將參與全球競爭,在與國際技術要求方面的差異不斷縮小乃至消失的同時,中國藥企也面臨著創新壓力。總局加入ICH體現出國際社會對中國政府藥品審評審批制度改革的支持和信心。同時,也意味著中國的藥品監管部門、制藥行業和研發機構,將逐步轉化和實施國際最高技術標准和指南,可以有效提升國內制藥産業創新能力和國際競爭力。
● 審評審批提速,國産創新藥加速落地
在改革藥品審評審批制度、解決藥品審評積壓的背景下,爲使具有臨床價值的新藥和臨床急需仿制藥盡快上市,提高市場短缺藥品的可及性,2016年2月26日,國家食品藥品監督管理總局(CFDA)頒布了《關于解決藥品注冊申請積壓實行優先審評審批的意見》。2018年國家藥監局藥審中心明確對申請人提出的優先審評申請采取即到即審方式,組織專家進行審核,並重點考慮近年來美國、歐盟或日本批准上市但中國尚未上市的用于罕見病治療的新藥,以及防治嚴重危及生命疾病且尚無有效治療或預防手段的藥品。
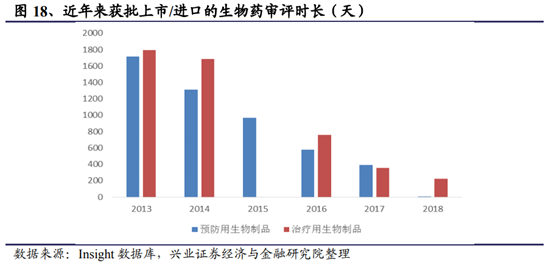
從微觀層面來看,經過國家藥監局近幾年多管齊下的政策改革,審評人員的增多、審評速度也顯著加快。以近年來獲批上市/進口的生物藥審評時長爲例,治療用生物制品其審評時長已經從2013年超過1600天逐步壓縮到不到300天的水平,審評速度和效率有了顯著提升。
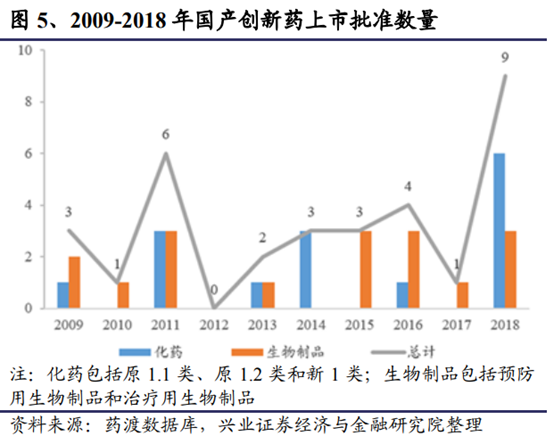
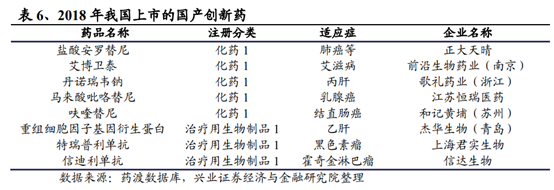
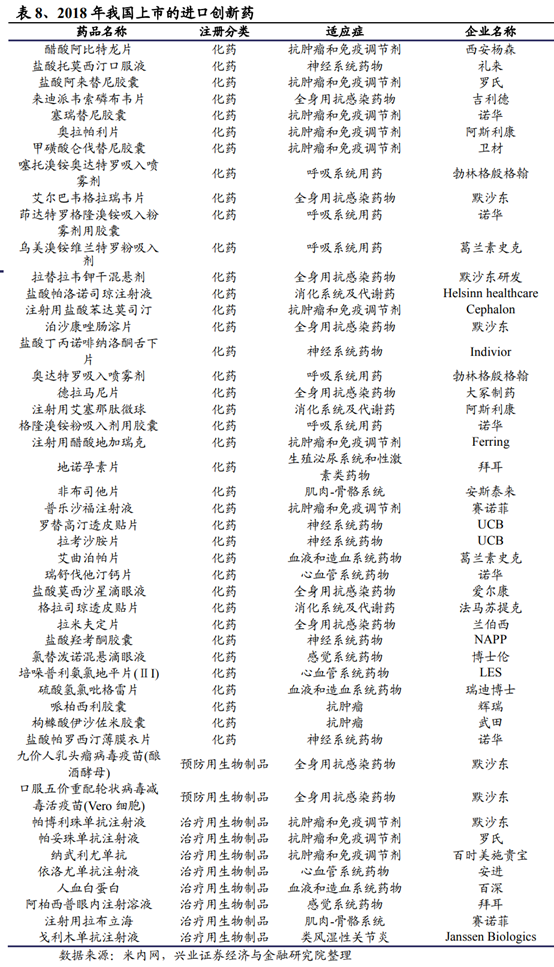
2015年以來隨著一系列針對國內創新藥研發端激勵不足、臨床試驗産能受限、臨床和上市申報審批時間過長等制約因素的改革措施陸續落地,爲創新藥提供了諸多實際的利好,一批重要或急需的品種在2018年獲批上市實現彎道超車。國內企業獲批方面,安羅替尼、吡咯替尼等一系列具備一定臨床特點或有效的産品不斷湧現。整體來看,2018年國內的藥物研發申報數量和上市數量均呈逐步上升的趨勢。
3.2、獲批加速之下國産創新藥面臨新挑戰
● 進口創新藥加速獲批,中外産品面臨同台競技
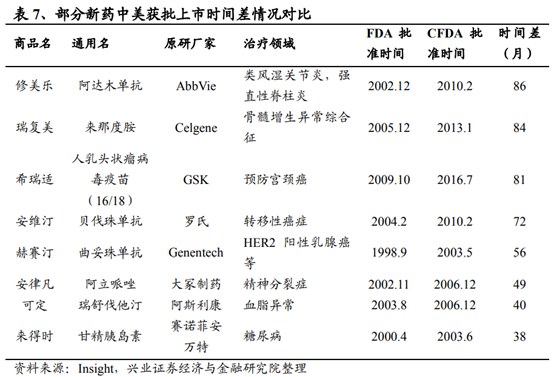
此前,大量的國外上市創新藥受制于審評速度,國內的上市時間往往晚于國外數年之久,以AbbVie的重磅藥物修美樂爲例,FDA早在2002年12月就批准其在美國上市,而在中國的獲批時間爲2010年2月,整整滯後86個月。
隨著鼓勵進口藥政策的陸續頒布,境外未上市新藥有望經批准後在境內外同步開展臨床試驗,並且在中國完成國際多中心藥物臨床試驗後,可以直接提出藥品上市注冊申請;對于已上市藥品,境外臨床試驗數據無人種差異可直接申報上市,這些政策進一步加快了進口專利藥的上市速度。後續隨著腫瘤藥關稅降低和進入醫保談判目錄等政策的施行,進口藥後續放量的進度有望加快,這些將對國內制藥企業帶來一定程度挑戰,過去創新層次較低的Me-Too甚至Me-Worse藥將受到沖擊。
● 熱門靶點競爭激烈,企業研發和立項難度提升
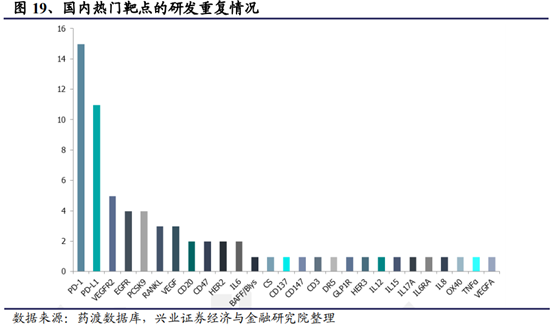
對于國內研發企業而言由于創新藥的研發品種相對有限,同類品種同靶點品種較多,預計將面臨紮堆申報、競爭壓力變大、審批難度增加的現象。
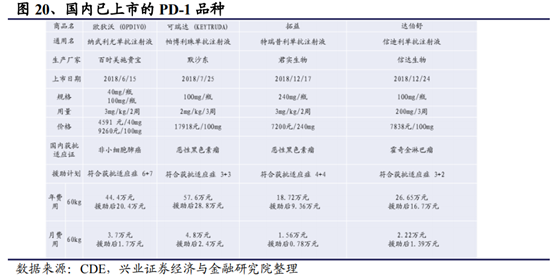
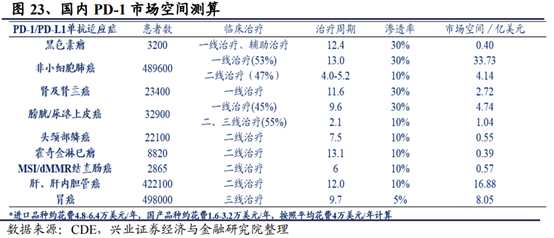
以熱門的腫瘤免疫治療爲例。其利用人體自身的免疫系統抵禦癌症,通過阻斷PD-1/PD-L1信號通路使癌細胞死亡,具有治療多種類型腫瘤的潛力,作爲時下最火的靶點,藥企對PD-1/PD-L1給予了超乎尋常的關注,在研發投入上也是不遺余力。截至目前,NMPA已批准4款抗PD-1類藥物,包括BMS的Opdivo、默沙東的Keytruda、君實生物的特瑞普利單抗和信達生物的信迪利單抗。從競爭格局上看,競爭激烈的PD-1領域已經基本形成了2(外資企業)+4(國內企業)的競爭格局,預計後續跟進研發的其它企業在療效沒有優勢的情況下預計可以分得的市場份額比較有限,且申報獲批的難度也將逐步增加。
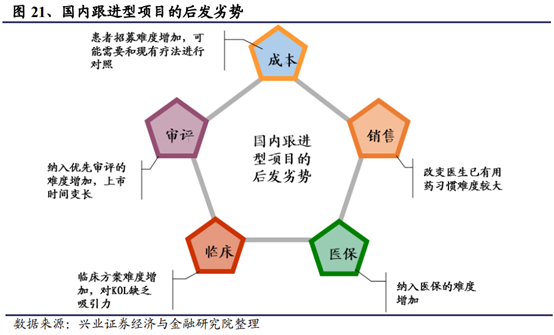
整體來看,在激烈的競爭之下,部分跟進型項目往往較難做出顯著的臨床差異,從而使得其在患者招募、臨床成本、審評時間、醫保覆蓋和營銷上往往面臨一定的後發劣勢。使得項目上市後的收益可能低于此前的預期。因此對于企業從研發項目立項開始就提出了更高的要求,在做“加法”的同時往往也需要結合現有品種的研發進度對後續前景不確定的項目做“減法”。
● 産品定價面臨新挑戰
激烈的競爭之下即使後面相關的産品獲批也未必能夠獲得研發企業預期的定價。不光在國內如此,阿達木單抗在歐洲也遇到了類似的情況。在2018年10月31日在歐洲的專利到期之後截至到2018年底,已經有安進、三星、BI等開發的8種生物類似藥在歐洲獲得上市批准,作爲原研的艾伯維(Abbvie)不得不將歐洲地區的藥價下調80%以進一步吸引患者和阻止競爭者進一步進入。
同樣以PD-1爲例,從價格來看,海外如目前美國市場PD-1/PD-L1療法花費大約是16萬美元/美元(約合人民幣104萬)。以100mg/10ml的Opdivo爲例,美國的價格約爲1.8萬一支(約2700美元),而在亞洲其他地區,,日本的價格最高,今年初調價後還需要約2萬多元一支;新加坡的價格是1.5萬元一支;印度的價格也是1.5萬元一支;香港地區的價格約爲1.6-1.7萬元一支。考慮到中國國內的巨大市場以及國內PD-1單抗研發的巨大競爭性,兩個國外廠家都非常激進地爲中國患者量身定制了一個極低的“友情價”,100mg/10ml的Opdivo價格爲9260元,再加上贈藥,價格就更低了,幾乎都是全球最低價。同時君實生物的國內首款具有自主知識産權的抗PD-1單抗(商品名:拓益)的價格定爲7200元/240mg(支)。按照此定價,預計一年治療費用約18.7萬元左右,同時考慮到贈藥政策(符合條件的黑色素瘤患者,每自費使用4個周期,可享用慈善援助4個周期),預計實際一年治療費用接近10萬元。不考慮贈藥,君實生物PD-1單抗與同樣適應症的帕博利珠單抗(年費用60.9萬元)相比,拓益的年治療費用也不到進口藥的1/3。
此外,由于相關創新藥後續納入醫保之後在患者支付能力、擴大患者滲透率的同時也面臨著大幅降價的壓力。創新藥上市支出制定價格時往往也需要爲後續的醫保談判留足空間。
值得注意的是,由于談判之後往往贈藥政策會取消,因此實際的價格降幅往往會較公布的談判降幅顯著減少。且由于國內龐大的患者基數,若降價能確實帶來患者滲透率的顯著提升,則創新藥品種對應的市場規模依然會相對比較樂觀。
3.3、中國式的biotech和中國的bigpharma
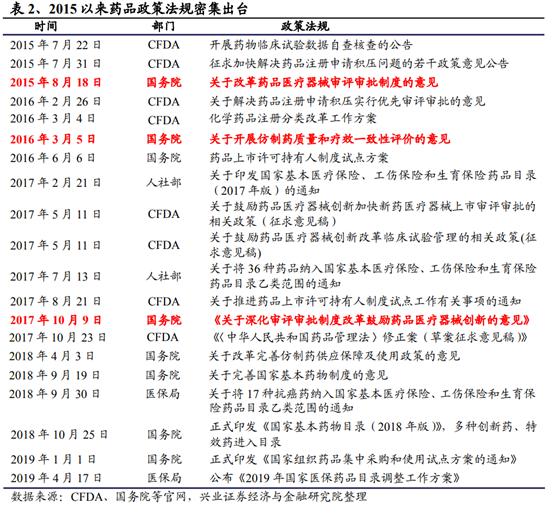
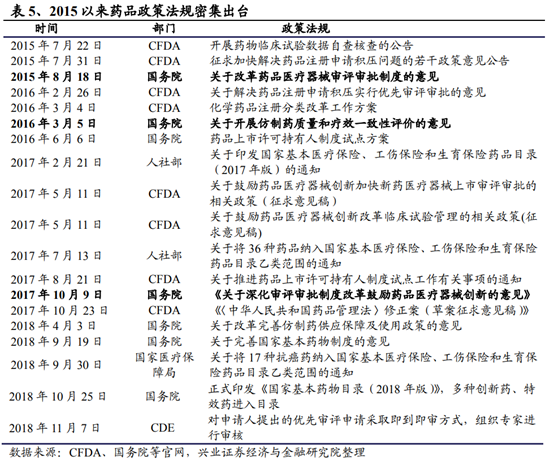
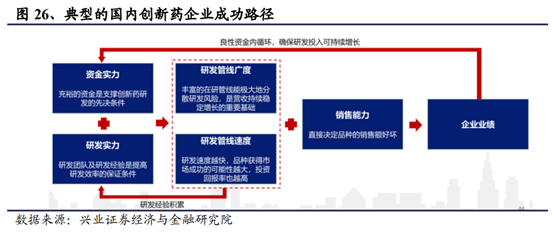
從曆史來看,此前國內的醫藥企業受制于資金、人才及政策等因素,創新能力普遍薄弱,低價仿制藥曾一度成爲中國藥企賴以謀生的主要策略。而具有強大研發實力的大型跨國藥企則依靠專利保護及品牌優勢占據主流醫院的高端用藥市場,享受藥價上的“超國民待遇”。但2015年以來,在提升藥品研發質量上,國家陸續出台臨床數據自查核查、化學藥注冊分類改革、仿制藥一致性評價等政策;在鼓勵和加快新藥研發方面,推行全面落實藥品上市許可持有人制度、優先審評加快新藥上市進度、取消臨床試驗基地的GLP認證制度,采取備案制度,緩解現階段臨床試驗産能短缺;規定新藥臨床申請試驗申請60天時限,加快創新藥上市審評、現場檢查的進度,破除限速步驟加快新藥研發進程。在上述政策的推動下,産業界創新藥研發成果不斷落地,中國的醫藥産業步入了新的發展階段。
從産業層面來看,從2016年起,藥品研發的申報數量從臨床核查後的低谷逐步回升,2018年化藥、生物制品、中藥的申報數量都創了2016年以來的新高,我們預計後續這一趨勢仍將持續,産品研發的層次也將逐步提升。隨著一批具備海外科研和跨國藥企管理經驗的人才陸續加入本土的醫藥科技企業,疊加資本市場和産業政策的助力,國內新藥研發領域正在步入新的階段,景氣程度仍將長期持續。
資本市場層面,過往中國一級市場的健全與繁榮催生了一大批目前已有多個在研産品處于臨床後期的創新藥企業,經過多輪的市場檢驗與融資,市值已如滾雪球般不斷上升,亟待進入二級市場,爲企業注入新鮮血液的同時,擴大企業影響力,協同産品銷售,並爲之後與大型成熟要求的合作牽線搭橋。而在科創板提上日程之前,納斯達克與港交所成爲這些盈利規模小,甚至未盈利科創企業遠走海外的上市之所。隨著一、二級市場機制不斷健全與發展,廣闊的投融資平台爲中國新藥研發提供充足動力,加速産業創新升級。
長期來看,我們預計在市場競爭中勝出的國內的醫藥企業有望是以下兩類:
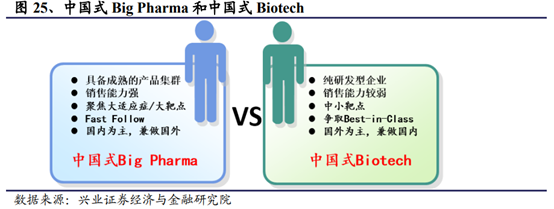
A:)中國式BigPharma
以恒瑞醫藥、中國生物制藥爲代表的大型仿制藥企業通過自主研發及並購成功升級爲創新藥企業。上述企業此前通過仿制藥實現了資本和技術的積累,在部分特定領域已經具備了比較成熟的産品集群和銷售網絡,對資本市場的依賴程度較低。研發方面往往針對在研靶點進行快速跟進,立足于自身有銷售優勢的國內的大病種,立足國內市場,尋求時機將部分有海外潛力的品種探索國際化。
B:)中國式Biotech
以百濟神州、信達生物爲代表的生而創新的研發驅動型Biotech。和國內傳統的大藥企不同,該類公司往往由研發人才設立,布局較爲前沿的靶點,借助風投、IPO等融資,持續加大研發投入。目前比較流行的趨勢是VIC模式,即“VC(風險投資)+IP(知識産權)+CRO(研發外包服務)”相結合的新藥研發模式,創新藥企從外部引進産品同時委托CRO公司進行區域性或者全球性的開發。從研發來看,其一般布局部分有優勢的特色中小靶點,其産品具備Best-in-Class的潛質,國際化的前景較國內一般的傳統藥企強。
整體來看,中國醫藥産業的創新研發水平與國際的差距正在逐步收窄。從研發層次來看,全新創新(first-in-class)類創新藥物的研發是我國從醫藥大國轉變爲醫藥強國的重要途徑。我國創新的層次主要處于以仿制爲主到仿創結合的階段,對國內企業而言,結合當前國內臨床需求,在國際新藥産品基礎上開發藥效和安全性相似的藥物(me-too),或更好的新藥(me-better)是目前比較切實可行的創新路徑,也是國內創新藥研發的主流方向。對于部分在特定領域有一定積累的國內龍頭研發企業而言,在其相對有優勢的領域某種程度上也已經具備了研發(firstin-class)品種的潛力。中國正在經曆“仿制藥-難仿藥-同類最佳-同類首創”的轉變與突破。與此同時,中國醫藥企業的研發費用也在快速增加,向全球行業平均水平逐步趨近,尤其是創新藥轉型企業。2018年恒瑞醫藥的研發投入爲26.70億元人民幣,研發費用率爲15.3%;港股未盈利生物技術公司則更爲注重研發投入,絕對數值甚至超過諸多盈利能力頗爲強勁的大型A股上市公司,2018年百濟神州的研發投入爲46.60億元人民幣,信達生物的研發投入爲12.22億元人民幣。我們預計在未來的中國市場上,能夠適應新的藥政審評環境並持續投入創新藥研發的企業數量有限,但大浪淘沙之下上述企業將得到快速發展的機會。創新藥相關標的長期來看仍將是高確定性的産業贏家,考慮到中國龐大的醫藥市場和未來國際化水平的提升,國內龍頭企業遠期市值空間依然值得期待。
● 投資人開始關注收入變化,國內bigpharma銷售能力會占據優勢
如果說PD-1單抗在獲批之前,投資人關注的是産品何時獲批的話。那麽當藥物陸續上市之後,投資人便要開始關注對應品種的收入變化了,而這時企業的股價也會因爲銷售的此消彼長出現分化。
在這方面,bigpharma的銷售能力會有相當的優勢,從曆史來看,無論是國內還是國外的大型企業,在新産品上量方面確實有著小型biotech公司無法企及的天然優勢,而在中國市場,銷售能力的重要性較國外甚至更爲突出。近年來,無論是阿斯利康的泰瑞莎、BMS和默沙東的“O藥”“K藥”,還是恒瑞醫藥的阿帕替尼,在獲批後都出現了快速的放量,一些大型藥企甚至在自身此前的非主打領域也取得了超預期的成果(典型的例子是中國生物制藥的安羅替尼)。
當然,biotech依托優秀的産品力也創造過不少突出的成績,曆史上典型的例子便是貝達藥業的埃克替尼。這就需要生物技術公司尋找到理想的、未被滿足的醫療需求(例如同靶點進口藥可及性不足、價格偏高、或是中國特色的適應症)。從2019年Q1來看,君實生物、信達生物也獲得了不俗的成績(我們推測第一年的銷售體量都會在5-8億級別),值得期待。
● 全球性品種交易的新格局,“交叉購買”可能會是新模式
可以預見,隨著越來越多的類似PD-1單抗這樣的品種上市,無論是實業界還是投資界對于創新藥的理解都將會更加深入。在我們看來,中國與國際上的biotech和bigpharma可能會發生“交叉購買”的情況。
對于中國的bigpharma來說,可能會優先購買國外優秀biotech産品的中國區權益。一方面,這些中國大型藥企的銷售網絡還沒有實現國際化,僅在中國具有本土優勢,因此購買中國區的權益不僅價格更便宜(真正first-in-class産品的全球權益動辄數十億美金,對中國大型藥企而言依然難以支付),且在目前中國加入ICH,承認國際多中心臨床數據的背景下,這些品種進入中國的速度也會較之前大大加快。同時,中國的創新藥企業在成功資本化之後往往也走上了BD海外創新藥中國區權益的做法,從而使得産品組合更加豐富。
另一方面,對于中國的biotech而言,未來其産品除了在中國區的銷售價值之外,也將具備全球範圍內的交易價值。當然,我們說的是那些是有能力研發best-in-class乃至first-in-class新藥的企業,而非“inChina,forChinaonly”的me-too藥企(這類産品在國際上的交易價值很小)。這部分優秀公司在全球範圍內的商業價值有望遠超中國本土市場,從而將其核心品種的國際權益通過授權轉讓的方法給予跨國大藥企。相信隨著這類産品會隨著中國biotech的公司研發能力的提升而越來越多。
而對于我們醫藥投研人員而言,未來如何能夠更好的提升自身專業性——包括新靶點成藥性的初步判斷、臨床試驗方案的解讀、臨床試驗數據分析,以及銷售能力的評估,將成爲在醫藥領域成功投資的必要條件。醫藥研究員將從傳統的“消費品研究方法”逐步轉向“技術驅動型的研究方法”,醫藥投研的門檻將會進一步提升。
第四篇:非藥領域避風港依舊
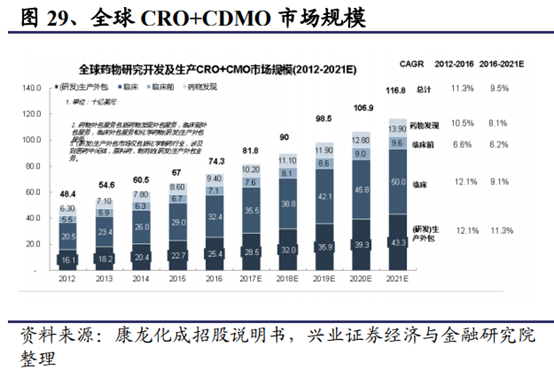
4.1、創新藥産業鏈方興未艾
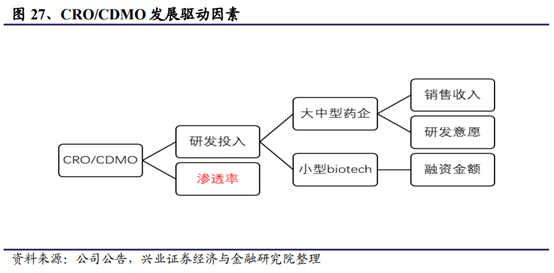
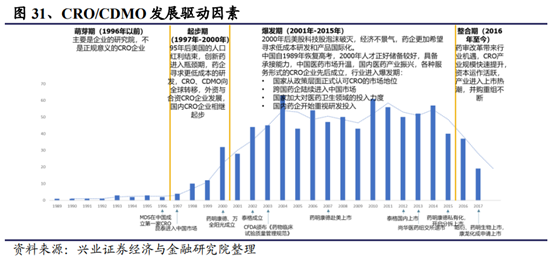
全球創新藥和中國創新藥的持續研發投入是推動CRO産業持續發展的重要推動力。
在研新藥數量和醫藥研發投入是影響CRO行業整體發展的最直接和最主要的因素,市場滲透率是CRO行業發展的保障。
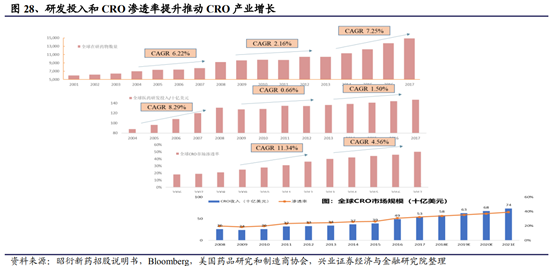
● 全球CRO發展伴隨研發收入周期呈現明顯的周期性。
結合全球醫藥研發投入和在研新藥數量,可將CRO發展分爲三個階段:
1)創新快速驅動發展:2000年-2008年,在研數量、研發投入迅速增長,滲透率開始提升,共同驅動CRO産業發展。本階段新藥在研數量快速增長,年均複合增長率達6.22%,醫藥研發投入年均複合增長率8.29%,同時CRO的服務模式逐漸爲醫藥企業所接受,此階段CRO企業淨利潤迅速增長,龍沙和科文斯股價表現優秀,漲幅明顯高于醫療保健指數和大盤。
2)滲透率緩慢驅動發展:2008-2013年,在研數量、研發投入增長緩慢,滲透率大幅提升,爲後續發展奠定基礎。此階段,受金融危機影響,醫藥企業利潤下滑,CRO的較低成本研發模式更爲醫藥企業所接受,CRO市場滲透率大幅提高。但由于危機後新增在研項目和藥企研發投入減少,新增訂單量的低于往年
3)創新、滲透率提高雙重快速驅動發展:2013年至今,研發投入恢複增長,在研數量快速增加,高滲透率帶動CRO産業快速成長2013年後,金融危機影響基本消除,醫藥企業重新恢複。在研數量快速增加,年均複合增長率達7.25%,醫藥研發投入增長率也恢複到1.50%。CRO已成爲醫藥企業開展新藥研發的主流模式之一,在滲透率已超過40%的情況下,CRO企業訂單量快速提升。
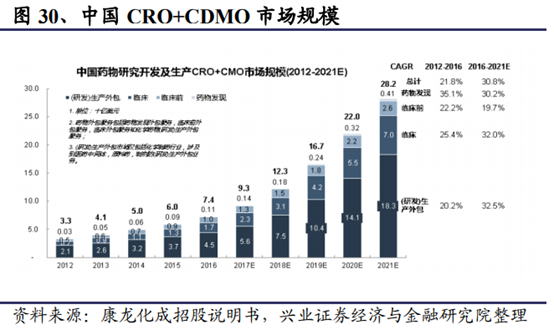
● 國內的工程師紅利使CRO往中國轉移,中國CRO增速是全球三倍
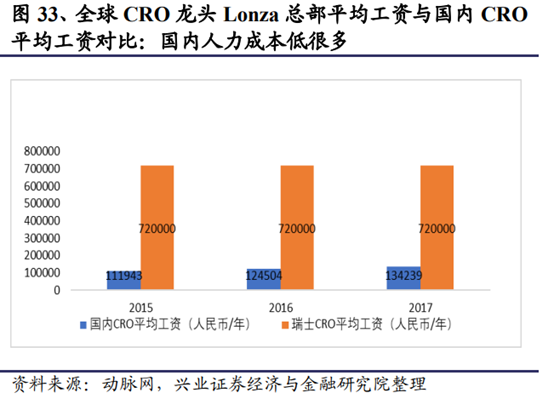
在人力成本低、效率高、質量優等相對優勢下,中國CRO較全球高速增長。
CRO往國內轉移有兩個因素:一是有足夠多的低廉勞動力,其邏輯與國內八、九十年代的人口紅利相同;二是低廉勞動力的素質足夠高,其邏輯則和美國九十年代的工程師紅利相同。
國內碩博人數逐年攀升,進入工程師紅利期:隨著高等教育的大規模擴招,國內的本碩博人才供給進入井噴期。這批年輕的高素質人才成本低、效率高、質量好,使國內的CRO産業技術水平能與全球其他地區比肩,同時爲CRO産業的轉移提供了巨大的成本優勢。其中,藥物發現階段的CRO業務人力成本占比大,對人力成本的敏感度更高,轉移速度更快。而臨床CRO由于藥品上市法規的限制,國際多中心的轉移不會太明顯,但國內廣闊的醫藥市場會持續吸引外資在國內開展臨床以謀求在中國上市。
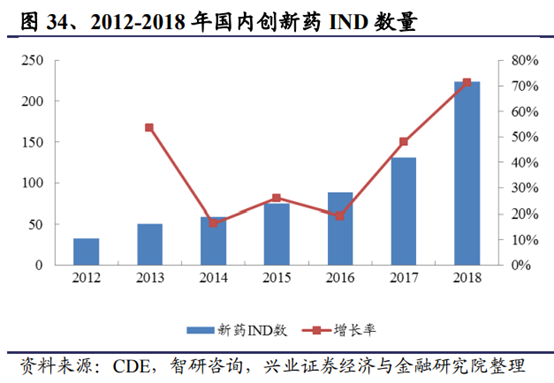
國內市場需求方面,當下正處于創新藥研發需求的井噴期,在需求大于供給的環境下,公司國內業務發展進入快車道。分析國內創新藥項目數量情況,以國內創新藥IND數量爲指標,近兩年增速均超過50%,尤其是2018年增速達到約70%。而臨床前研發至IND至少有3年的滯後期,因此我們預計當前創新藥研發熱情將可能更爲旺盛。同時,近兩年國內創新型公司融資金額快速增長,2018年增速達到約80%,資金投入也相應流入CRO市場。在這種環境下,研發項目同質化難以避免,促使競爭加劇,研發速度、成功率及質量成爲重要要素。CRO/CDMO在國內迎來爆發期。
CRO/CDMO板塊投資策略:
研發投入是CRO、CDMO的源頭活水,CRO、CDMO是研發投入順周期下的高β板塊;
科創板推動國內創新藥大潮,國內研發投入進入順周期;
IO免疫療法帶來的收入增長和美股的寬松融資環境推動國際研發投入進入順周期,疊加工程師紅利帶來的中國轉移,國內的CRO/CDMO將享受高于全球CRO/CDMO的增速。
個股邏輯:行業紅利來臨時,龍頭優先受益
CRO/CDMO存在的價值本質上是技術質量、效率、成本的兼顧。從個股來看,龍頭公司在三者的平衡上更好,且在行業裏更有品牌,考慮到下遊藥企較爲分散,已經有品牌和口碑的企業將在這一輪紅利中率先受益。我們看好泰格醫藥、凱萊英、藥明康德等,也建議關注藥石科技、昭衍新藥。
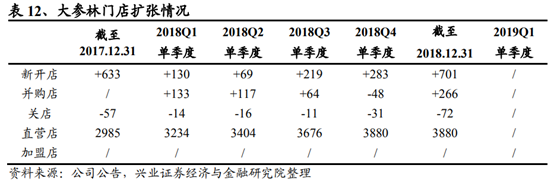
4.2、連鎖藥店:藥店業績超預期,性價比高
中短期看,今年一季度連鎖藥店板塊普遍業績超預期,我們預計全年業績趨勢仍將持續向好
從一季度上市公司業績看,普遍向好。益豐藥房2019年一季報實現營業收入24.69億元(+66.67%),歸屬于母公司的淨利潤1.47億元(+45.77%);大參林2019年一季度實現營業收入25.78億元(+26.77%),歸屬于母公司的淨利潤1.84億元(+25.20%);一心堂2019年一季度實現營業收入25.88億元(+18.77%),歸屬于母公司的淨利潤1.75億元(+33.51%);老百姓2019年一季度實現營業收入27.27億元(+23.37%),歸屬于母公司的淨利潤1.59億元(+22.13%)。
背後的驅動因素我們認爲主要是以下幾種:
幾大政策助力行業整體向好
1)減稅利好,近期推出小規模納稅人、增值稅降低等減稅政策對藥店利好;
2)醫保管理規範化,非醫保産品限制銷售、個人賬戶改革等政策預示著未來醫保監管將不斷趨嚴,在此情況下管理更規範、抗風險能力更強的龍頭企業競爭力將不斷提升。
資本優勢帶來持續穩定的業績增長
資本優勢助力連鎖藥店上市公司持續加快擴張速度:新增自建店數量持續增長,政策限制中小連鎖藥店發展,出售意願增強,去年下半年以來一級市場上收購價格有所回落。持續擴張幫助企業實現次新店比例逐步提升,並爲後續增長提供了穩定的支撐。
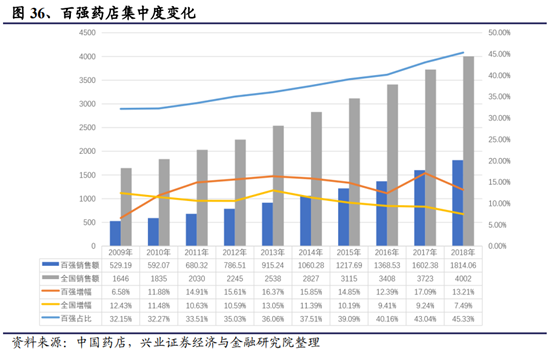
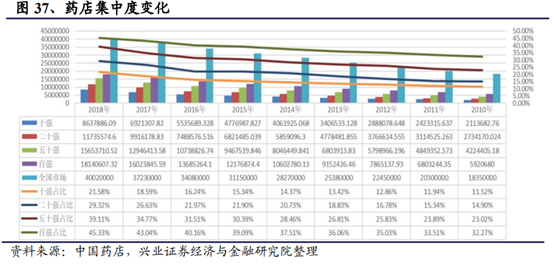
集中度提升是中短期推動龍頭業績增速較快增長的基石
藥店行業全國格局未定,各區域龍頭並存,零售行業在經曆白熱化競爭和互聯網沖擊情況後,已經進入精細化管理和差異化競爭時代,只有個別公司在行業裏勝出。從下面數據可見,強者恒強態勢已經越發明顯。
從中長期看,我們認爲醫藥分開是大勢所趨
近年來,零售藥品市場規模穩步增長,2018年實現收入4002億元,同比增長7.49%。未來隨著醫藥分開,80%的處方藥份額流向藥品零售端,藥品零售端空間將變大。
重點推薦業績加速的益豐藥房、大參林、一心堂、老百姓。
總體而言,根據一季度業績情況和藥店板塊長期穩定的增長邏輯來看,益豐藥房、大參林、一心堂、老百姓全年展望良好,我們繼續看好連鎖藥店醫藥分開、集中度提升的邏輯。
4.3、醫療服務:依舊是高景氣度行業
● 從量上看,醫療服務的需求是持續上升,未被充分滿足
總量方面,20余年來,我國衛生總費用增長了約253倍,醫學專業畢業人數增長了約25倍;但同期,衛生機構數量僅增長6倍,衛生床位數增長3倍,而衛生人員數量也增長緩慢,診療總人次增速始終快于醫療機構數量、床位數、衛生人員數量的增速,顯示出嚴重的總量供給不足。雖然我國醫療服務資源的供給量逐年增長,但醫療資源總量仍不足。
● 從價格來看,消費升級驅使下,未來價格還有提升趨勢
伴隨著基本醫療需求被滿足,消費者對于更加私密、舒適的就醫環境及更加高品質、個性化的醫療需求越來越多。國內爲數不少的民營醫療服務企業積極布局高端醫療服務,以醫療服務細分子行業愛爾眼科等爲代表。
近視手術專科是愛爾眼科重點高新技術項目,治療技術發展推動單價提升。目前主要應用于臨床治療近視的5類手術包括准分子、全准分子、飛秒激光、全飛秒激光手術以及眼內晶體植入術(ICL)。隨著技術革新以及設備更新換代,傳統的准分子激光手術逐漸被飛秒激光及ICL晶體植入術替代。在經過多年的臨床使用後,顧客對新技術的接受程度逐漸提高。上述趨勢共同促使客單價逐漸由1萬提升至2萬左右。
● 從醫保管控看,民營醫院注重醫療服務,在醫保重點管控藥價的情況下,受到的影響較小
專科醫院的利潤大多數來自于醫療服務,少數如整形、口腔來自于耗材與器械(但也多屬于自費項目),因此在醫保整個控費降價的壓力下,民營醫院受到的壓力較小,此外醫保騰籠換鳥,在鼓勵提高門診挂號費情況下,民營醫院有望提升醫療服務價格。
綜上,醫院是醫保控費降價趨勢下的避風港行業,在未來醫保控費降價中,醫療服務行業仍然有望維持量價齊升趨勢,估值合適時候可以大膽布局該細分領域。重點推薦愛爾眼科等。
4.4、醫療器械和IVD存在結構性機會
● 我國醫療器械發展黃金十年將至
我國醫療器械行業規模從2006年的434億元增長至2017年的4425億元,年均複合增長率約爲23.50%,行業正處于快速發展期。根據《中國醫療器械行業發展報告》統計,2013-2016年醫療儀器設備及器械制造子行業在工信部統計的醫藥行業8個子行業中,年增幅一直高于平均水平,2016年的增幅位于8個子行業之首,規模以上生産企業主營業務收入增速爲11.66%-22.20%,明顯高于同期國民經濟發展增速。預計到2020年我國醫療器械行業年銷售額將超過7000億元人民幣,未來10年我國醫療器械行業複合增速超過10%。
歐美日等發達國家和地區的醫療器械産業發展時間早,對醫療器械産品的技術水平和質量要求較高,市場需求以産品升級換代爲主,市場規模龐大,增長穩定。根據EvaluateMedTech統計,2017年全球醫療器械銷售規模爲4050億美元,預計2024年將超過5945億美元,期間年均複合增長率將保持在5.60%。其中,美國是醫療器械最主要的市場和制造國,占全球醫療器械市場約40%市場份額,美國醫療器械行業擁有強大的研發實力,技術水平世界領先。歐洲是全球第二大醫療器械市場和制造地區,占全球醫療器械市場約30%市場份額,德國和法國是歐洲醫療器械的主要制造國。新興市場是全球最具潛力的醫療器械市場,産品普及需求與升級換代需求並存,近年來增長速度較快。中國已經成爲全球醫療器械的重要生産基地,在多種中低端醫療器械産品領域,産量位居世界第一。最近20年,中國醫療器械行業進入黃金發展期,2016年總體銷售規模占全球市場的14%左右。
根據《中國醫療器械行業發展報告(2017)》,截至2016年底,我國藥品和醫療器械人均消費額的比例僅爲1:0.35,遠低于1:0.7的全球平均水平,更低于發達國家1:0.98的水平。與發達國家相比,目前我國醫療器械行業存在的問題主要是研發能力不足,創新能力薄弱,研究設備和基礎條件差,科技成果轉化能力薄弱。但由于龐大的消費群體和政府的積極支持,我國醫療器械市場發展空間極爲廣闊。
2019年第一季度,A股醫療器械板塊業績位于各細分子行業之首,根據我們的統計,42家A股醫療器械上市公司一季度收入增長22.83%,淨利潤增長27.53%,扣非淨利潤增長21.79%。由于醫療器械當下依然屬于政策避風港類標的,主要龍頭公司在內生外延的雙重發力下表現良好,細分行業龍頭如健帆生物、安圖生物等業績超預期。
複盤美股過去幾年醫療器械板塊和醫藥板塊的走勢,以2014年初爲起點,道瓊斯醫療器械指數相對漲幅約108%,而道瓊斯醫藥指數漲幅僅有31%。類似地,在A股中,醫療器械子板塊表現優于SW醫藥生物,又優于化學制藥子板塊。以2014年初爲起點,截至2015年年中,醫療器械板塊最高累計漲幅約260%,而SW醫藥生物和SW化學制藥漲幅分別爲166%與143%。
醫療器械板塊可攻可守,政策壓力下凸顯較好防禦性,政策利好下超額收益最明顯。總體來說,醫療器械行業相比藥品行業具備比較優勢。對比我國及全球醫療器械企業的市值,我國企業的市值較國際巨頭有很大的成長空間,潛力巨大。
● 內因外因雙輪驅動國産醫療器械需求增長
隨著我國人口老齡化程度的加速上升,65歲以上人口對醫療檢查的需求更大;藥占比限制、藥品零差率、破除以藥養醫等政策有利于檢驗科室收入增長;分級診療推動基層市場放量;國家鼓勵社會辦醫,民營醫院對各類設備的需求越來越旺盛;無論從內因還是外因來看,我國醫療器械市場處于較好的發展環境,驅動行業需求持續增長。
● 藥占比限制和藥品零差率政策有利于檢驗科室收入增長
藥占比限制催生檢驗增加的跷跷板效應,藥品零差率削弱藥品科室盈利能力,兩方面驅動醫療器械成爲公立醫院重要的收入端。長期以來,我國大型三甲醫院藥品銷售是收入的重要部分,即所謂的“以藥養醫”。2015年國務院發布的《關于城市公立醫院綜合改革試點的指導意見》明確提出,力爭在2017年將試點城市公立醫院藥占比(不含中藥飲片)總體降到30%左右,預示著醫院收入結構將出現大的調整。2017年,公立醫院綜合改革政策全面推開,截至9月底,全國所有公立醫院取消藥品加成,各大省份紛紛出台“藥品零差率”制度。爲了維持醫院利潤實現穩健增長,大部分公立醫院開始通過增加檢查來提高檢驗收入。
在醫改政策實施之前,醫院檢驗檢查收入占醫院整體收入比重長期以來比較穩定,近年來開始逐步提升,全國公立醫院檢查收入占比平均已從2010年的10.07%逐漸增加至2017年的11.02%,四年提升了0.95pp,檢查收入逐漸成爲醫院端的“利潤中心”,各大醫院也開始提高檢驗科的重視度。2017年,公立醫院檢查收入同比增長11.43%,而藥品收入的同比增速僅爲-0.5%,公立醫院門診、住院病人次均檢驗收入增長均快于藥品收入增長,且近年來增速差距愈發擴大,體現出“嚴控藥占比”背景下醫院IVD行業向好發展的勢態。
● 分級診療大蛋糕,基層追求性價比
2015年是分級診療政策發布的起點,隨著相關制度的不斷施行,2017-2018年基層診療人次增速明顯上升,且高于高等級醫院,體現出基層診療需求快速增長的勢頭。2020年是分級診療規定服務能力全面提升的目標年,我們預計分級診療帶動的醫療器械采購周期還能持續至少三年,目前處在景氣周期向上的起點。由于基層醫療機構更注重性價比,所以國産儀器將核心受益。
我國不同地區、不同級別醫療機構的醫療服務能力呈現出明顯的分化狀態,基層醫院受制于財政和醫療資源有限,在醫療設備的配置上明顯落後于高等級醫院,只能從事一些常規低端的診療項目,一些高端的如DR、CT、核磁、彩超等檢查項目無法開展,而這又反過來制約了基層醫院醫療服務能力的提升。近年來,基層招標采購項目呈現逐步增多的趨勢,國家財政及各省級財政投入較多的補助資金。中低端醫療器械市場將會出現快速增長,由于目前我國基層醫療機構(主要指3.7萬鄉鎮衛生院和3.5萬社區衛生服務中心)醫療器械配備水平較低,急需“填補缺口”和“更新換代”。
此外,在分級診療的政策大背景下,國家積極鼓勵縣級醫院、鄉鎮衛生院以及社區衛生服務中心的升級。2018年11月,國家衛健委印發《全面提升縣級醫院綜合能力工作方案(2018-2020年)》,指出到2020年,500家縣醫院(包括部分貧困縣縣醫院)和縣中醫醫院分別達到“三級醫院”和“三級中醫醫院”服務能力要求,除了國家層面上政策的傾斜,最近兩年,各省也紛紛出台政策或措施,或直接給予財政撥款,大力推進縣級醫院的發展。這些資金將主要用于業務用房的改擴建和醫療設備裝備,例如廣東省除了給予財政支持外,還給出了具體的配置清單,被列入清單內的醫療設備將優先被采購。
2018年9月,國家衛健委、國家中醫藥局發布《關于開展“優質服務基層行”活動的通知》,同時發布了鄉鎮衛生院服務能力標准(2018年版)和社區衛生服務中心服務能力標准(2018年版),對于這兩類醫療機構的設備配置做出明確要求,力爭使鄉鎮衛生院和社區衛生服務中心的服務能力達到基本標准,部分服務能力較強的鄉鎮衛生院和社區衛生服務中心達到推薦標准,達到基本標准或推薦標准的機構按程序可以向省級衛生健康行政部門申請審核,2019年6月底前將名單報國家衛生健康委備案,達到推薦標准的鄉鎮衛生院,符合相關條件的可參加二級醫院評審。這意味著3.7萬的鄉鎮衛生院和3.5萬社區衛生服務中心將加快實現達標建設,醫療設備配置也成爲重中之重。
對比縣級二級醫院以及鄉鎮衛生院主要醫療設備配置,我們預計彩超、DR、CT、全自動生化分析儀、全自動化學發光免疫分析儀等爲達到A檔及B檔鄉鎮衛生院的新增設備,將迎來基層采購放量周期。
● 關注未來五到十年有望實現進口替代的黃金細分領域
目前,國産醫療設備已逐步突破多項技術壁壘,已經基本實現進口替代(國産占比超過50%)的細分領域包括:1)植入性耗材中的心血管支架、心髒封堵器、人工腦膜、骨科植入物中的創傷類及脊柱類産品等;2)大中型醫療設備中的監護儀、DR等;3)體外診斷領域的生化診斷;4)家用醫療器械中的制氧機、血壓計等。
追溯我國已經實現進口替代的器械細分領域的成功經驗,技術、品牌、性價比、渠道都是國産企業的制勝法寶,政策對于國産産品的支持也起到一定助推作用。乘著分級診療、基層放量的東風,在國家政策不斷向國産設備傾斜的大趨勢下,中國將有望迎來國産設備繁榮發展的新階段,預計未來五到十年又將有多個細分領域完成進口替代。國內龍頭將享有行業高增速及進口替代的雙重驅動,行業集中度提升,市場競爭格局重塑,這樣的領域是器械領域投資的黃金細分,主要包括大中型設備中的彩超、CT、MRI、內窺鏡,IVD領域的化學發光、分子診斷等。
以彩超爲例,我們認爲未來五年是國內彩超完成進口替代的關鍵五年,伴隨著以邁瑞醫療、開立醫療爲首的國産彩超企業技術平台不斷升級。邁瑞醫療2013年並購高端超聲影像制造商Zonare加快了公司産品向高端延伸的進程,2016-2017年,公司先後推出了Resona7等高端彩超産品,受到市場的廣泛認可,公司超聲影像類産品的整體形象快速提升。開立醫療于2016年底推出全新高端S50彩超平台,上市後迅速放量,目前S50在總收入中的占比提升到近25%,今年一季度又推出嵌入人工智能的S60彩超平台,配置第二代的單晶探頭,成像速度、信噪比、靈敏度都有所提升,預計未來3年內高端彩超收入占比能夠達到40%以上,醫院覆蓋率的提升以及存量儀器的更新換代促進彩超的銷售。國産企業超聲核心部件的研發水平已媲美GPS,超聲探頭技術是決定超聲系統性能的核心技術之一,例如開立醫療在當今超聲領域最高端的單晶探頭技術方面,跻身國際一流水平,爲整個系統性能的先進性提供了核心技術保障。
● 尋找政策“避風港”投資機會
國家層面的醫用耗材集中采購政策最早可追溯至2000年國務院體改辦等八部聯合發布《關于城鎮醫藥衛生體制改革的指導意見》,意見提出要進行藥品集中招標采購工作試點,開啓了我國醫藥行業集中采購的先河。根據中國醫療器械行業發展報告,可將2000年以來醫療器械集中采購的發展曆程分爲四個階段,各個階段都有相關國家政策出台。
回顧集中采購的發展曆程以及實施情況,可以發現我國耗材集采降價相較于藥品推進的時間和速度均較爲滯後。這主要是因爲醫療器械與藥品不同,沒有“原研”和“仿制”的區別,各類器械規格參數衆多,難以進行“一致性”評價。質量分級只能通過臨床數據、醫生評價以及産品材料進行質量區分;其次,規格衆多使得廠商可以鑽低價中標,高價進院的空子,降價效果不理想,急需國家規範注冊證的適用範圍,避免産品“挂靠”。
在2018年醫保局推行“4+7”藥品帶量采購後,預計2019年高值耗材將成爲醫保局下一步集采的重點。一是高值耗材是醫療器械中相對容易標准化的類目,二是因爲高值耗材降價對醫院盈利能力的影響較小,廠家經受的降價壓力也能部分轉嫁到流通環節。對于醫院,手術等醫療服務費用一直在提高,耗材盈利能力下降處于可接受範圍;對于廠商,由于集采之前經銷商利潤空間大,集采降價壓力一部分由經銷商承擔,傳導到生産廠商降價的幅度減小。然而,高值耗材的帶量采購即使推出也需要一定時間准備,且由于規格參數衆多,不太可能像藥品一樣獨家中標。
對于IVD診斷試劑,雖然總體規模與高值耗材相近,但集采難度相對高值耗材更大,這主要是因爲IVD試劑不同于一般的耗材,部分品類的IVD試劑需要和儀器聯用,而儀器有一定的更新周期。集采試劑降低了價格,但大規模更換儀器對于醫院又增加了成本。我們認爲,耗材降價是大勢所趨,生産企業最終承擔的價格降幅在于渠道的利潤空間,如果渠道利潤空間較大,對于生産企業的影響則微乎其微。相較于進院價下調,我們認爲醫保局對于IVD試劑耗材可能從收費目錄著手,由于耗材的采購是不直接占用醫保費用,直接占用醫保的是檢驗費用,醫保局可能從統一各省收費標准開始,然而這又是利好國産IVD企業的,由于試劑耗材屬于醫院的成本端,國産試劑價格比進口低一半以上,醫院有動力采購國産試劑,有利于進口替代。
……
溫馨提示:如需原文檔,可在PC端登陸未來智庫www.vzkoo.com搜索下載本報告。
(報告來源:興業證券;分析師:徐佳熹、孫媛媛、趙壘、杜向陽、黃瀚漾)