導 讀
2019年7月11日,南京大學化學化工學院蔣錫群課題組、胡勇課題組、美國北卡羅來納大學Zhen Gu課題組在Nature Communications (IF: 12.124) 雜志上,發表題爲“Eradication ofunresectable liver metastasis through induction of tumour specific energydepletion”的論文,南京大學作爲第一單位。研究人員發現了一種能夠選擇性殺死肝轉移癌細胞的方法,並在基因和蛋白質水平上探討了潛在的分子機制。
內 容
肝癌是一種嚴重的惡性腫瘤,具有高轉移率,易致死等特點的重大疾病。迄今爲止,外科手術是臨床上處理肝癌轉移最有效的方法,不幸的是,大多數肝癌轉移病例被發現時已經是晚期,手術預後效果差。
彌漫性肝癌轉移是以多發性轉移結節爲特征,患病後會快速惡化。肝髒作爲一個負責高強度代謝活動的器官,本身極易受到化療相關並發症的影響,從而縮短患者化療後的生存期。一些新出現的治療藥物,如伊尼帕裏布和尼拉帕裏布,能夠通過利用合成致死機制,抑制具有獨特基因組特征的癌細胞。盡管在一定程度上對患者有所幫助,但若用來治療肝癌轉移效果很差。此外,它們都屬于精確到分子水平的治療,適應症較窄。因此,發展更有效的治療方法來延長彌漫性肝癌轉移患者的壽命仍是一項緊迫任務。
圖1. Mito(T)-pep-Nuc(T)工作原理(圖片來源于NatureCommunicatio
近日,南京大學化學化工學院蔣錫群課題組、胡勇課題組、美國北卡羅來納大學Zhen Gu課題組,發現了一種能夠選擇性地殺死肝轉移癌細胞的策略。由于精確到細胞水平的靶向輸送在大多數情況下對癌細胞和健康細胞都是有害的,沒有選擇性。因此,如何利用靶向機制的傳遞策略,使病變位置成爲藥物積聚的唯一位置至關重要。爲了不影響正常細胞的同時且能夠有效治療彌漫性肝癌轉移,研究人員考慮采用非主動靶向給藥的替代方法,目的是通過利用腫瘤普遍存在的病理特征來限制癌細胞的作用。
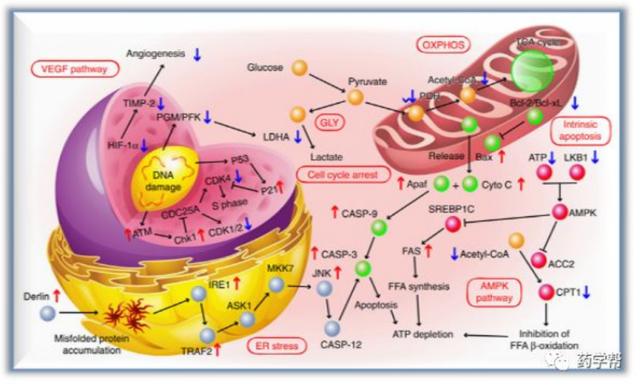
圖2. Mito(T)-pep-Nuc(T)在癌細胞的治療中可能的信號通路(圖片來源于NatureC
作者合成了一種由光敏劑(Ce6)包封的介孔二氧化硅納米粒子和W18O49納米粒子組成的混合體系。線粒體選擇性介孔二氧化硅納米粒子和W18O49納米粒子分別與三苯基膦(TPP)和核定位序列(NLS)功能化,從而使它們與線粒體和核進行選擇性結合。在癌細胞中,Mito(T)-pep-Nuc(T)在富含組織蛋白酶B的溶酶體中破裂,釋放具有不同亞細胞的Mito(T)和Nuc(T)。隨後,分別應用激光照射(633nM,隨後1064nM)來依次觸發Ce6和WONPs介導的光動力療法(PDT)和光熱療法(PTT)。兩種細胞器都可能被破壞,共同破壞ATP供應。同時,由于組織蛋白酶B活性不足,肽連接體在肝細胞中保持完整。在633nM激光照射下,産生的單峰氧可被WONP化學計量消耗,從而將其轉化爲光熱惰性WO3,並在1064nm激光照射下消除産生熱量。因此,肝細胞可以從PDT和PTT引起的破壞中解救出來。
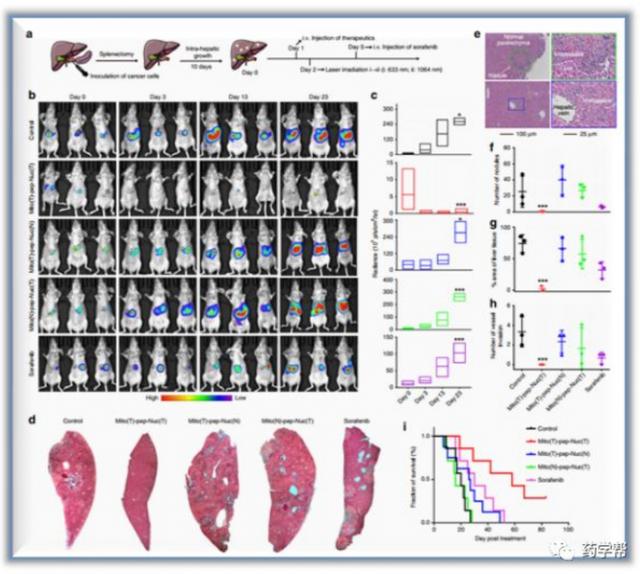
圖3. 體內抗轉移作用(圖片來源于NatureCommunications)
在肝細胞中,通過激光照射産生的單重態氧物質被wops消耗,導致其光熱加熱能力喪失,使肝細胞免受激光照射引起的熱損傷。相比之下,在癌細胞中,分裂的肽連接體允許wops和msns分別靶向細胞核和線粒體,從而釋放藥效。這會引起癌細胞能量來源被消除,從而達到選擇性地殺死肝轉移癌細胞的目的。作者進一步在基因和蛋白質水平上探討了潛在的分子機制,以更好地理解治療結果。
總結:該研究,作者充分考慮到複雜的肝髒生態位置,進行了全新靶向策略的設計。實驗證明同時阻斷癌細胞中gly和oxphos的活性可以有效地消除肝轉移癌細胞,同時不影響正常肝細胞。基于代謝的腫瘤選擇性治療策略在該研究中被證明是通過利用能量消耗機制來克服肝轉移癌細胞。研究人員考察了它們與細胞成分的相互作用及其對細胞代謝方式的影響。進一步的炎症反應驗證結果,證實了該策略的有效性和兼容性。
✔蔣錫群教授簡介
蔣錫群教授(圖片來源于南京大學官網)
【個人簡曆】
蔣錫群,1983年本科畢業于南京大學化學系,1986年碩士畢業于南京大學化學系高分子材料專業,1995年被教育部選派以中日聯合培養博士生身份赴日本九州大學學習,並于1998年獲南京大學博士學位。1999年-2000年,在美國威斯康星大學從事博士後的研究工作。現爲南京大學化學化工學院教授,博士生導師,高分子科學與工程系主任,高性能高分子材料與技術教育部重點實驗室主任,高分子功能構造與結構調控教育部創新團隊負責人。2006年獲國家傑出青年科學基金。近5年來主持了包括國家傑出青年基金及國家自然科學基金重點項目在內的十余項國家及省部項目。其研究方向爲:大分子自組裝、高分子藥物傳輸系統、高分子影像材料,高分子納米簿膜和高分子表面等。在Nature Communications, J. Am. Chem. Soc., Angew.Chem. Int. Ed., Advance Materials, ACS Nano等學術刊物上發表論文130余篇,論文他引3300余次。獲美國專利授權2項,國家發明專利授權8項。獲2013年度“中國化學會高分子科學創新論文獎”。
✔胡勇教授簡介
胡勇教授(圖片來源于南京大學官網)
【個人簡曆】
1993年9月進入南京大學化學化工學院高分子系,1997年獲學士學位、2002年獲博士(2002)學位。2002年7月到2003年12月在南京大學物理系系進行博士後研究;2003年12月到2004年12月在新加坡國立大學-約翰霍布津斯大學聯合研究院做博士後;2005年11月到2006年3月,2008年9月到2008年10月,在新加坡-麻省理工聯合研究院做博士後研究;2010年7月到2011年8月,德國Duisburg-Essen大學化學系洪堡學者。2006年3月到2006年12月,南京大學材料系講師,2006年12月起在南京大學現代工程與應用學院任講師、副教授、教授。
主要從事生物醫用高分子材料和高分子複合材料的研究,包:生物降解高分子醫用材料、聚電解質納米材料、高分子納米藥物載體以及非病毒性納米基因載體,納米磷酸鈣骨組織工程材料。與合作者在Angew. Chem. Int. Edit.,Adv. Mater.,Biomaterials, Biomacromolecules,J. Control. Release,Chem. Comm. 等重要國際學術刊物發表論文40多篇,總引用超過1000次(其中,單篇論文引用超過100次的有3篇)。已經申請發明專利6項,獲得一項關于快速止血的納米生物材料的世界專利1項(US 60/479,096)。作爲項目負責人獲得多項國家自然科學基金。在高分子複合材料研究領域,主要研究特殊用途納米塗層複合物材料及粘合劑,和企業合作開發的産品獲得2010年教育部科技進步推廣類二等獎(金屬表面高性能納米防護技術及産業)。獲德國洪堡基金會的資助,在德國Duisburg-Essen大學進行爲期一年的洪堡學者研究。Advanced Powder Technology的國際編委。