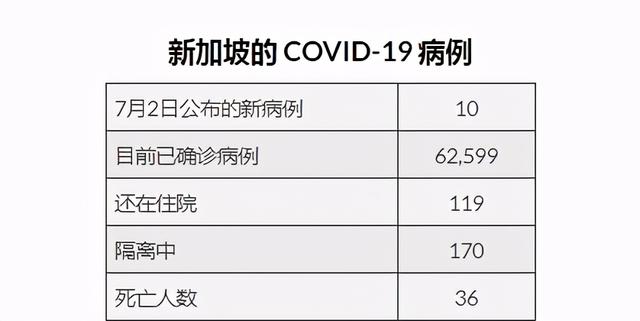
截止到7月2日,
新加坡衛生部報告了10例新增確診病例!
- 3例新的本土病例,其中一例與以前的病例沒有聯系,這是五天內第一次無關聯的本地感染;
- 4個境外輸入人員在抵達新加坡時被檢測出呈陽性;
- 剩下的3個確診病例則是在入境後居家隔離被發現的。
(圖片來自:CNA)
爲了解不同冠病疫苗的免疫保護作用,衛生部將與國家傳染病中心合作,邀請3600名對首劑信使核糖核酸(mRNA)冠病疫苗過敏的人接種兩劑科興疫苗,並監測是否出現副作用。
“先信使、後科興”
衛生部將與國家傳染病中心合作,開展“先信使、後科興”計劃(Sinovac After mRNA,簡稱SAM),監測部分參與研究的接種者是否出現副作用。
科興疫苗尚未被納入新加坡的全國疫苗接種計劃,目前只有采用mRNA技術的輝瑞/複必泰(Comirnaty)和莫德納疫苗屬于全國計劃。
受邀加入“先信使、後科興”的人,得到公共醫院的診所接種,以便當局密切監測是否出現副作用,以及收集更多疫苗安全數據。
接種者必須在接種科興疫苗後的第一、第三和第七天接受問卷調查,通報是否出現任何症狀或反應。
領導這項研究的是國家傳染病中心高度隔離病房主任林寶蓮副教授,她也是衛生部冠病疫苗專家團成員。
衛生部已聯系約3600名對首劑mRNA冠病疫苗過敏者,超過1400人表示有興趣。衛生部將通知他們如何參加並免費接種科興疫苗。
“新加坡冠病疫苗免疫反應和保護作用”
國家傳染病中心也將邀請SAM計劃的其中200名受試者,參與另一項名爲“新加坡冠病疫苗免疫反應和保護作用”(Singapore COVID-19 Vaccine Immune Response and Protection Study,簡稱SCOPE)的研究。
這項由國家傳染病中心顧問醫生巴納比·揚(Barnaby Young)領導的大型研究,旨在了解對首劑mRNA冠病疫苗過敏者,接種科興疫苗後的免疫反應和免疫期。
受試者須在接種每劑科興疫苗後,以及接種後的兩個月、六個月和12個月進行抽血檢測。
新增七家私人醫療機構
衛生部7月2日晚間宣布新增七家私人醫療機構獲選,可在特別采用程序下爲公衆提供科興疫苗(Sinovac),讓可施打科興疫苗的診所增加到31家。
新增提供科興疫苗接種服務的機構:
- HeartlandHe alth(循環路)
- Heartland Health(新樟宜路上段)
- 安微尼亞山醫療中心內的Icon Cancer Centre
- 諾維娜醫療中心內Icon Health Screening
- Pinnacle家庭診所(兀蘭)
- Pinnacle家庭診所(油池)
- 湯申全科診所
接種首劑信使疫苗後出現過敏反應而不能接種第二劑的人,也可選擇等待衛生部引進其他非信使疫苗,但這些疫苗必須獲得新加坡衛生科學局批准,並納入全國疫苗接種計劃。
不過,如果這些過敏者希望通過特別采用程序接種科興疫苗,衛生部已制定了一個專門的計劃,讓他們在公共醫院的診所接種疫苗,以密切監測任何副作用。
爲避免排隊,想要接種科興疫苗的人應致電診所或訪問其網站進行預約,然後再前往接種疫苗。
私人診所有權將未經事先預約就走進診所的人拒之門外。避免排隊也是爲了保障安全距離措施,避免人群擠在診所。
衛生部重申,科興疫苗不在疫苗傷害經濟援助計劃 (VIFAP) 範圍內,所以希望接種科興疫苗的個人應與這些選定的私營醫療機構的醫生討論其風險和益處,並共同做出明智的決定。
並且新加坡衛生部明確指出若群衆接種的是科興疫苗,在參與大型活動之前,仍要接受新冠檢測。因爲關于科興疫苗針對 Delta 變體的有效性的國際數據不足。
諾瓦瓦克斯重組蛋白疫苗
衛生部長王乙康上周透露,新加坡已經同美國醫藥公司諾瓦瓦克斯Novavax簽署預購協議,購買該公司的重組蛋白疫苗,並有望在今年年底前送達新加坡。這款疫苗目前仍在進行第三期臨床試驗。
諾瓦瓦克斯公司生産的是一款重組蛋白疫苗,采用蛋白質亞基(protein subunit)和重組病毒糖蛋白納米顆粒(recombinant nanoparticle)技術,和目前人們熟悉的乙型肝炎或破傷風疫苗原理相同,讓人體免疫系統對疫苗中的蛋白質産生反應。
諾瓦瓦克斯6月14日發聲明表示,公司在美國和墨西哥119個地點對2萬9960人進行研究,以評估疫苗的效能、安全性,以及免疫原性。
疫苗對預防中度和重症冠病的效能達100%,整體效能爲90.4%。公司計劃今年第三季向美國和歐洲的監管局申請使用。
新加坡國立大學蘇瑞福公共衛生學院院長張毅穎教說:“增加疫苗的種類是爲確保疫苗來源多元化。更重要的是,這不是一款mRNA疫苗,能保護不適合接種mRNA疫苗的人。臨床數據顯示這款疫苗的效能很高,和輝瑞與莫德納等mRNA疫苗相近。”