出品 | AI科技大本營(ID:rgznai100)
11月17日,騰訊公布了一項人工智能助力藥物發現的新進展。
通過騰訊自研的提升蛋白質結構預測精度的新方法,聯合研究團隊首次解析了II型5a還原酶(SRD5A2)的三維結構,揭示了治療脫發和前列腺增生的藥物分子“非那雄胺”對于該酶的抑制機制,這將有助于深化研究相關疾病的病理學機制及藥物優化。
此次,騰訊 AI Lab 采用“從頭折疊”的蛋白質結構預測方法幫助解析了SRD5A2晶體結構,並通過自研AI工具“ tFold”有效提升了蛋白質結構預測精度,在科研突破中發揮了核心作用。除了在SRD5A2結構中的應用,這套方法還可以拓展應用于蛋白質分子和病理學機制的相關研究中。
該項聯合研究成果于近日登上了國際頂級期刊 Nature 子刊《 Nature Communications》。論文題爲《人體類固醇II型5a還原酶與抗雄激素藥物非那雄胺的結構研究》,由南科大生物系魏志毅副教授課題組與匹茲堡大學張誠教授、新加坡 A*STAR 研究所範昊研究員、騰訊 AI Lab 黃俊洲博士帶領的研究小組合作完成。
論文鏈接:https://www.nature.com/articles/s41467-020-19249-z
據了解,tFold工具還在CAMEO(全球唯一的蛋白質結構預測自動評估平台)的國際測評中連續半年保持周度冠軍。目前,tFold公測版本已通過騰訊「雲深智藥(iDrug)」平台官網對外開放。
鏈接:
https://drug.ai.tencent.com/console/cn/tfold
“從頭折疊”新方法破解晶體學難題
在人體內,性激素有促進性器官成熟、副性征發育及維持性功能等作用。
二氫睾酮是人體中已知最強的雄激素,對于人體的發育和生理活動至關重要,但同時也需要保持合理的平衡。一方面,二氫睾酮控制著男性性器官的發育,水平過低將導致男性性征缺陷。另一方面,水平過高又是導致前列腺增生和脫發的罪魁禍首。
合成性激素依賴類固醇還原酶,二氫睾酮即由 SRD5A2 催化合成。因此,當患者因爲二氫睾酮水平過高而出現前列腺增生和脫發問題時,可以通過抑制 SRD5A2 來降低患者二氫睾酮水平。作爲SRD5A2 的高效抑制劑,非那雄胺(finasteride)被廣泛用于治療這類疾病。
盡管 SRD5A2 具有重要生理作用,其高分辨率結構信息卻十分缺乏,導致 SRD5A2 催化二氫睾酮合成的機理以及非那雄胺抑制 SRD5A2 酶活的機制並不清晰。
這是由于 SRD5A2 具有獨特的七次跨膜結構,其與人類全部已知結構的蛋白在結構上存在較大差異,難以通過“模板建模”(template-based modeling)方法獲得初始構型來解析晶體數據。同時又因爲 SRD5A2 是一類多次跨膜蛋白,使得傳統的用于獲取蛋白質晶體相位信息的“重原子替代”(Heavy-atom derivatization)方法亦難以奏效。
爲了解決這一難題,騰訊 AI Lab 科研團隊采用了難度更高的“從頭折疊”(de novo folding)方法來預測 SRD5A2 蛋白的三維結構,並將其用于“分子置換”(molecular replacement, MR)的初始構型來解析晶體數據。
所謂“從頭折疊”,是相對于“模板建模”的一種蛋白質結構預測方法。“模板建模”是目前最普遍的蛋白結構預測手段,但有一個使用前提——人類已知的蛋白結構數據庫(即PDB)當中,必須存在和預測的蛋白相似的結構,否則就無法使用。而騰訊AI Lab采用的“從頭折疊”方法則跳出了這個限制,可以不依賴于模板來預測蛋白結構。
但此前,通過“從頭折疊”方法預測的蛋白質結構精度不高,難以滿足晶體數據解析的精度需要。而在騰訊 tFold 工具加持下得到的高精度“從頭折疊”的結構模型,爲分子置換方法提供相位,繼而解析確定2.8Å 原子級別精度的SRD5A2晶體結構。
這一結果能直接推進我們對體內 SRD5A2 活性失調引發的各類疾病的理解,進而爲基于 SRD5A2 結構的藥物開發提供更多有價值的參考信息。
《Nature Communications》的一位評審對此創新方法給予了高度評價:“作者能用預測的分子置換(MR)模型來確定晶體結構,這一點非常有趣。本評審認爲該技術確實非常出色,整個X射線晶體學界將從該方法中受益匪淺。”
自研冠軍級 tFold 工具突破蛋白質結構預測精度
騰訊 AI Lab 自研的 tFold 工具正是破解 SRD5A2 蛋白結構這一重要難題的關鍵。爲了提升“從頭折疊”方法(又稱“自由建模”)的精度,tFold 工具通過三項技術創新,實現了蛋白結構預測精度的大幅提升。
首先,實驗室研發了“多數據來源融合”(multi-source fusion)技術,來挖掘多組多序列聯配(multiplesequence alignment, MSA)中的共進化信息。
然後,借助 “深度交叉注意力殘差網絡” (deep cross-attention residual network,DCARN),能極大提高一些重要的蛋白2D結構信息(如:殘基對距離矩陣)的預測精度。
最後,通過一種新穎的“模板輔助自由建模“(Template-based Free Modeling, TBFM)方法,將自由建模(Free Modeling, FM)和模板建模(Template-based Modeling, TBM)生成的3D模型中的結構信息加以有效融合,從而大大提高了最終3D建模的准確性。
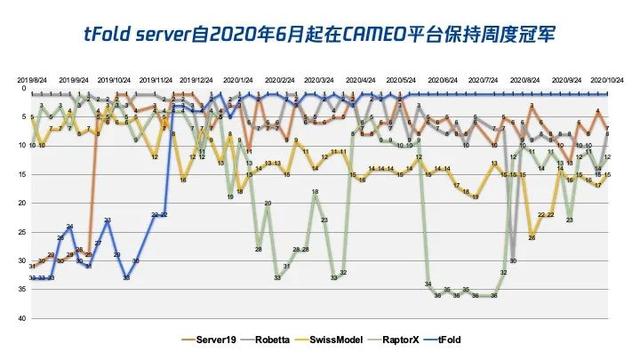
在研究方面,tFold 平台已在國際公認最權威的測試平台CAMEO上證明其創新價值及有效性。騰訊 AI Lab 于2020年初在CAMEO平台注冊了自動化蛋白結構預測服務器 tFold server,並自2020年6月起至今一直保持周度(圖1)、月度、季度、半年度冠軍。tFold server在一般案例上領先業內權威方法6%以上,在困難案例上則領先12%以上。
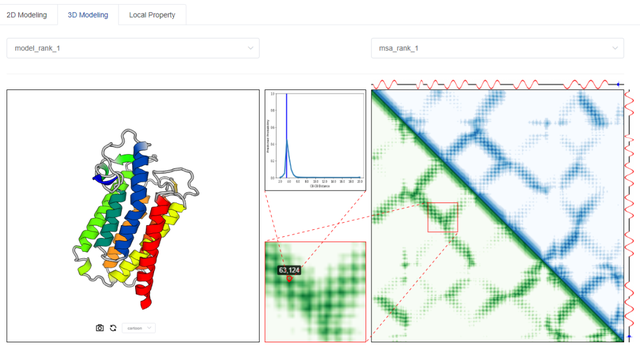
在應用方面,tFold server的公測版也已經在騰訊「雲深智藥」平台發布。用戶可以手動輸入待預測的氨基酸序列或從本地上傳FASTA 格式的序列文件。在經過一定時間的計算之後,用戶即可得到使用“從頭折疊”方法預測得到高精確度蛋白結構(下圖)。
tFold server的3D Modeling輸出頁面。左邊部分爲從頭折疊得到的3D蛋白模型;右邊部分是該3D模型在給定的預測殘基對距離矩陣下的偏差。
騰訊「雲深智藥」用AI持續助力藥物發現
依托大數據挖掘與機器學習等先進技術優勢,騰訊正致力于推動AI與醫療産業的深度結合,助力社會整體醫療水平提升。
據了解,「雲深智藥」是騰訊發布的首個AI驅動的藥物發現平台,整合了騰訊 AI Lab和騰訊雲在前沿算法、優化數據庫以及計算資源上的優勢,致力于幫助用戶大幅度減少尋找潛在活性化合物的時間和成本。
騰訊「雲深智藥」平台主要功能
「雲深智藥」的五大模塊覆蓋臨床前新藥發現全流程,目前各功能模塊正持續完善與升級。除蛋白質結構預測外,平台還上線了分子生成模塊。AI驅動的分子生成模型是輔助小分子藥物設計的重要工具之一,不僅能加速藥物發現流程,還能啓發藥化專家跳出現有的分子庫,探索更大的化合物空間。該模塊還整合了ADMET屬性預測功能,可對生成的新分子實時進行屬性篩選。
據介紹,平台的逆合成算法也已取得了一定進展,計劃于明年上線。其它小分子和大分子藥物發現功能模塊也將逐步上線。
除藥物研發以外,騰訊 AI Lab 也在影像篩查、病理診斷等多個醫療領域持續探索,不斷拓展和深化研究與應用。
在AI助力醫療技術方面,實驗室聯合多家合作單位研發了中國首款智能顯微鏡,幫助醫生提高工作效率。2020年10月,在免疫組化樣本(IHC)分析的基礎上,智能顯微鏡新增了針對宮頸液基細胞(TCT)標本進行臨床樣本的顯微圖像進行觀察、篩選、標記功能,並已獲得國家藥監局審批證書。
在病理研究領域,騰訊 AI Lab 也研發出了世界領先的前沿算法,比如斬獲MICCAI 2020 CPM-RadPath 挑戰賽第一名的算法,能夠准確區分神經膠質瘤(大腦最常見腫瘤)的不同亞型並進行分級,有望彌補人工診斷效率低、主觀因素影響較大等問題。
此外,騰訊 AI Lab 在今年早些時候與南方醫院合作發表了名爲《基于病理圖片的結直腸癌微衛星不穩定性預測模型的開發和解釋》的文章,利用算法模型可輔助病理醫生篩查結直腸癌中微衛星不穩定亞型,降低微衛星不穩定篩查的條件要求,幫助更多的地方醫院也有能力執行這樣的篩查。