近兩年來,衆多細胞免疫療法紛紛崛起,發展迅猛,無疑掀起了一場癌症治療的熱潮。
那麽,細胞療法治療癌症到底靠不靠譜呢?
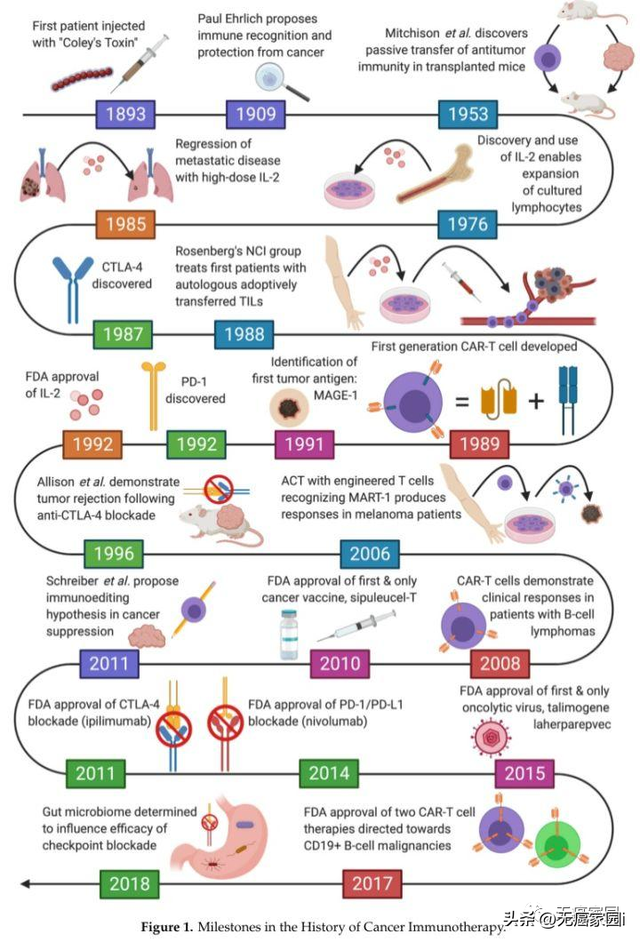
其實,免疫治療已有100多年的曆史,只是近兩年才逐漸走入大衆視野,而且受到世界腫瘤學界的絕對認可。
癌症免疫療法曆史上的裏程碑事件
2013年《科學》雜志評出的年度十大科學突破排行榜中,免疫治療高居榜首。近年來,免疫治療是國內外腫瘤治療研究領域的熱點之一,大量臨床研究均顯示出令人振奮的成果。
其中,細胞免疫療法利用的就是人體免疫系統的自我保護及查殺能力,來實現抗腫瘤的作用。通過把患者體內具有免疫功能的細胞提出體外培養、增殖,通過技術手段讓它們擁有攻擊腫瘤細胞的能力,然後再輸入患者體內,實現自身抗癌。這種療法針對免疫細胞,而不是癌細胞,也不像手術、放療、化療那樣會對患者身體造成巨大危害,對于早期癌症患者可以直接治療,特別是配合手術後對殘留癌細胞的攻擊效果最明顯。
從近些年在科研和臨床上的迅猛發展來看,細胞免疫療法在精准性、有效性和安全性等方面更讓人寄予厚望,有望迅速崛起成爲抗癌療法的第四大支柱。接下來,無癌家園小編就對目前生物醫藥行業中的多種熱門及新興的細胞免疫療法等進行大致介紹和盤點,希望讓癌友們大致了解這一癌症治療領域的大致發展進程。
01
CAR-T細胞療法
CAR-T療法就是嵌合抗原受體T細胞免疫療法,是一種治療腫瘤的新型精准靶向療法。通過基因工程技術將T細胞激活,並裝上定位導航裝置CAR(腫瘤嵌合抗原受體),將T細胞這個普通“戰士”改造成“超級戰士”,即CAR-T細胞,專門識別體內腫瘤細胞,並高效殺滅腫瘤細胞,從而達到治療惡性腫瘤的目的。
目前,隨著2021年阿基侖賽注射液、瑞基奧侖賽注射液先後在中國獲批上市,2022年西達基奧侖賽被美國FDA獲批上市,CAR-T療法有望進入井噴期。的確,CAR-T技術在多種血液腫瘤,如白血病、淋巴瘤、多發性骨髓瘤中,表現出不俗的療效,讓許多瀕臨絕境、無藥可治的血癌患者,一大半都獲得了良好的療效。
2022年6月1日,美國癌症研究所Samik Upadhaya博士等學者對當前的癌症細胞治療前景、研發管線及臨床試驗做了深入分析,其中CAR-T療法又拔得頭籌!
截止到2022年4月15日,全球免疫腫瘤學管線中有2756種處于活躍開發狀態的細胞療法,比2021年同期增長36%。其中,CAR-T細胞療法獨占鳌頭,數目最多,相比去年增長24%。基于自然殺傷細胞(NK)療法的增長幅度也放緩,與去年相比增長55%。
在熱門靶點方面,與2021年一樣,CD19、BCMA、CD22、CD20、CD123仍然是血液腫瘤領域最常見的靶標;在實體瘤方面,腫瘤相關抗原 (TAA)、HER2、間皮素 (MSLN)、GPC2/3、EGFR是最常見的靶向蛋白。
CAR-T療法頗爲出圈的臨床研究
01 胃癌、胰腺癌
作爲國際上首個針對Claudin18.2的CAR-T細胞,CT041早在2019年ASCO年會上就嶄露頭角,當時總客觀緩解率爲33.3%就已經驚豔世界,如今更加顯著的療效無疑是錦上添花!此次的臨床數據展現出對消化系統腫瘤的良好治療前景!
國産CAR-T療法CT041閃耀國際
2022年5月9日,科濟藥業CAR-T細胞産品CT041治療消化系統腫瘤的研究結果發表在國際頂級期刊《Nature Medicine》雜志上,這也算是首個發表于頂級學術期刊的迄今爲止最大樣本量的CAR-T細胞治療實體瘤的臨床研究!
研究數據格外亮眼!
1. 所有患者的客觀緩解率達48.6%,疾病控制率達73%;所有胃癌患者總客觀緩解率爲57.1%,疾病控制率達75.0%。
2. 既往接受至少2線治療失敗的胃癌患者:客觀緩解率爲61.1%,疾病控制率爲83.3%。
3. 而且總體耐受性良好!
除此之外,還有多款靶向CLDN18.2的CAR-T細胞療法。例如,由傳奇生物研發的LB-1904,用于治療胃癌或者胰腺癌,目前已經進入臨床I期試驗。此外,我國自主研發的首個針對Claudin18.2的單抗AB011,用于治療晚期胃腺癌及實體瘤患者,目前也正在進行臨床試驗招募中。
目前急招B細胞淋巴瘤、T細胞淋巴瘤、T細胞白血病(T-ALL)、急性淋巴細胞白血病、多發性骨髓瘤、非霍奇金淋巴瘤、肝癌、胃癌、前列腺癌、甲狀腺癌、間皮瘤、卵巢癌等癌種!
想要評估病情是否能夠接受CAR-T療法可將病理報告、治療經曆及出院小結等提交至無癌家園醫學部四零零六二六九九一六進行初步評估!
02 肝癌
當前應用CAR-T治療肝癌的臨床試驗靶點主要是GPC3(磷脂酰肌醇蛋白多糖3)。
2022年8月18日,科濟藥業宣布,《Frontiers in Immunology》雜志上發表了關于其自主研發的靶向GPC3的CAR-T細胞候選産品CT011治療晚期肝細胞癌的長期生存案例報告。
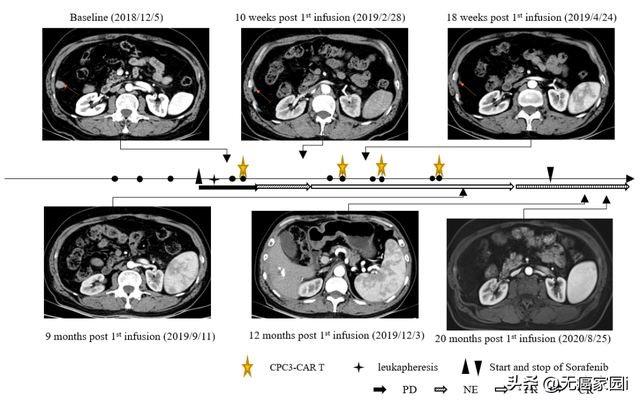
該研究團隊是最早報道了GPC3是CAR-T治療的理想靶點,且率先開展CAR-T治療肝細胞癌的臨床試驗。此項研究報道了1名晚期肝細胞癌患者在接受GPC3 CAR-T細胞與索拉非尼聯合治療後獲得了完全緩解(CR)和長期生存。
在第12個月時,4號靶病變的術後病理圖像
(圖像顯示大面積凝固斑塊壞死、外周纖維化、慢性炎性細胞浸潤、無明顯腫瘤殘留,表明抗腫瘤治療後有反應)
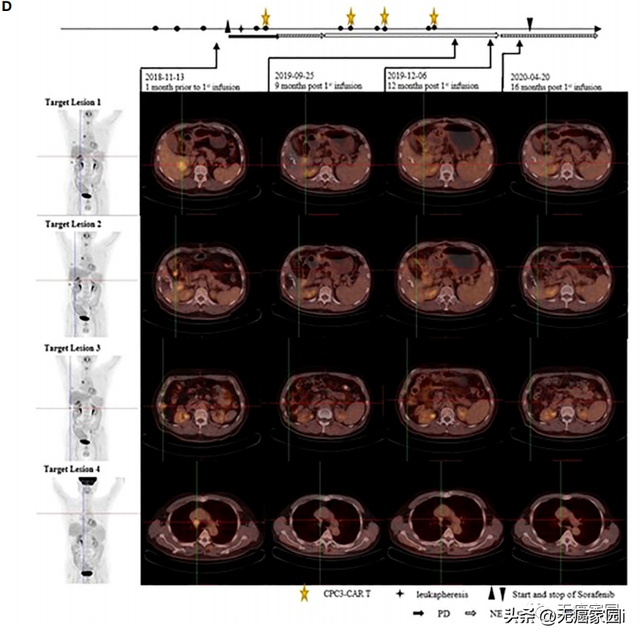
靶病變PET-CT圖像
(患者在基線時接受PET-CT檢查,首次輸注後6、9、12、16個月。1號、2號和3號靶病變在第12個月消失,而4號靶病變病變不活躍,在抗腫瘤治療後被認爲是非特異性攝取)
CT011聯合索拉非尼治療耐受性良好。患者從第3個月開始達到部分緩解(PR),並在第一個 CT011 輸注周期後的第12個月達到完全緩解。腫瘤超過36個月沒有進展,在第一次輸注後保持完全緩解狀態超過24個月。
據悉,這是CAR-T細胞與酪氨酸激酶抑制劑聯合治療後報告的首個完全緩解病例。臨床結果表明,GPC3 CAR-T細胞與索拉非尼的聯合治療,可能成爲治療GPC3表達陽性的晚期肝細胞癌患者的一種有前景的療法。
03 結直腸癌
2022年5月17日,上海斯丹賽生物公司宣布,其將出席2022年5月15日-5月19日在華盛頓舉行的美國基因與細胞治療學會(ASGCT)第25屆年會並做口頭報告。
會上,斯丹賽將做基于自主研發的CoupledCAR®平台技術開發的首發候選産品GCC19CART的報告,該産品被開發用于治療複發/難治性結直腸癌(R/R mCRC)患者。
據無癌家園小編獲悉,在本次ASGCT會議上,斯丹賽將會重點介紹來自中國5家臨床中心2個劑量爬坡試驗組21例患者的數據,驗證了GCC19CART産品的安全性和初步療效。其中13患者以1級劑量(1×106 cells/kg)入組,8名患者以2級劑量(2x106cells/kg)入組。根據實體腫瘤療效評價標准(RECIST1.1),1級劑量組客觀緩解率(ORR)爲15.4%(2/13),2級劑量組客觀緩解率爲50%(4/8)。
04 惡性間皮瘤
此項臨床試驗共納入10例晚期複發/難治性間皮瘤患者,所有患者至少接受過≥2線化療線失敗。
6例己可評價的間皮瘤患者,完全緩解(CR)1例,部分緩解(PR)2例,客觀緩解率爲50%;在PD-L1陽性≥5%的間皮瘤患者,獲得客觀緩解3例,客觀緩解率達到100%;截止發稿,入組的所有間皮瘤患者回輸後,持續生存,最長生存時間已達22個月,獲得完全緩解的患者持續無瘤生存已超過15個月,在完全緩解患者的外周血中持續檢出CAR-T自分泌的PD-1納米抗體達9個月。
臨床研究表明,自分泌PD1納米抗體間皮素CAR-T細胞能夠通過減少腫瘤負擔和延長生存期給複發/難治性間皮瘤患者帶來臨床獲益,尤其是PD-L1陽性的腫瘤患者,實現了腫瘤清除和長期無瘤生存。
05 卵巢癌
國際知名雜志《Journal of Hematology & Oncology》刊登了我國醫學研究者們的一項成功改造CAR-T技術的臨床研究,研究中提及的CAR-T産品選擇的靶點有mesothelin(MSLN,又稱爲間皮素,可以應用于多種上皮癌症,比如惡性間皮瘤、胰腺癌、胃癌、卵巢癌等)。
其中1例晚期胰腺癌患者,接受的是靜脈回輸的CAR-T治療,治療後全身的病竈,基本都實現了代謝活性完全消失。
靶向MSLN(間皮素)的CAR-T細胞療法及CAR-NK療法臨床試驗正在招募患者,有意向的間皮瘤患者及其他實體瘤患者可通過無癌家園醫學部提交病理報告、治療經曆及住院小結等資料初步評估是否可以采用此療法。
06 肺癌、膽道系統腫瘤、前列腺癌等
關于以下癌種的CAR-T療法請閱讀下文
肺癌:國人屢向非小細胞肺癌進軍,CAR-T聯手PD-1/L1,有效抑制腫瘤生長
膽道系統腫瘤:中國CAR-T技術首次碰撞膽道系統腫瘤,腫瘤完全消失,至今未複發!
前列腺癌:熱點!CAR-T之父公布首個實體瘤臨床試驗結果!曆時5年,CAR-T有望挺進一線治療!
02
TCR-T治療
CAR-T細胞和TCR-T細胞都屬于經基因工程技術改造的T細胞。相較于CAR-T療法,TCR-T療法在實體瘤治療領域具備獨特優勢。
TCR-T細胞療法可識別細胞膜表面或細胞內來源的腫瘤特異性抗原,已從最開始的基礎免疫研究走進臨床應用,在實體瘤中顯示出初步療效,成爲目前最有可能在實體瘤領域中取得突破的T細胞免疫療法!
1、國內多款TCR-T細胞療法獲批臨床,成爲治療肝癌新勢力
肝癌TCR-T産品獲批臨床情況
2022年5月9日,星漢德生物的SCG101自體T細胞注射液獲得新加坡藥監局(HSA)的臨床試驗批准。而在3月10日,中國國家藥品監督管理局藥品審評中心(CDE)公示顯示,SCG101自體T細胞注射液成功獲得臨床試驗默示許可,用于治療乙型肝炎病毒(HBV)相關的肝細胞癌(HCC)。
▲ 圖片來源:CDE官網
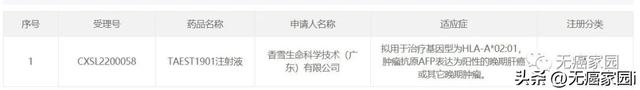
2022年4月20日,香雪生命科學的創新産品TAEST1901注射液,已獲得中國國家藥監局(NMPA)臨床試驗許可,擬用于治療組織基因型爲HLA-A*02:01、腫瘤抗原AFP表達爲陽性的晚期肝癌或其它晚期腫瘤。
▲ 圖片來源:CDE官網
2、晚期肝癌迎來新曙光!TCR-T療法讓癌症患者完全緩解
早在2020年國際肝病大會(ILC)上,一款基于T細胞的肝癌新型TCR-T療法ADP-A2AFP引起了不小的轟動,也讓肝癌的新療法有了新的突破。
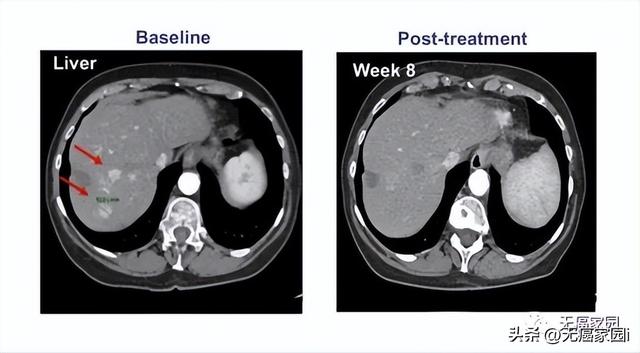
在納入的患者中,有一名患者的癌細胞進程出現了完全緩解(CR)的表現,其余參與者的甲胎蛋白(AFP)也都出現了不同程度的下降,這意味著試驗取得了進展,也說明該療法針對晚期肝癌的治療是有效果的。
參與的9例患者均接受過手術及常規放化療,但出現失敗或不耐受的現象。在接受最高劑量治療的4例患者中,有1例患者獲得完全緩解,CT掃描顯示,患者體內所有病變都消失了,而且完全緩解後已持續半年以上無任何複發的狀態!
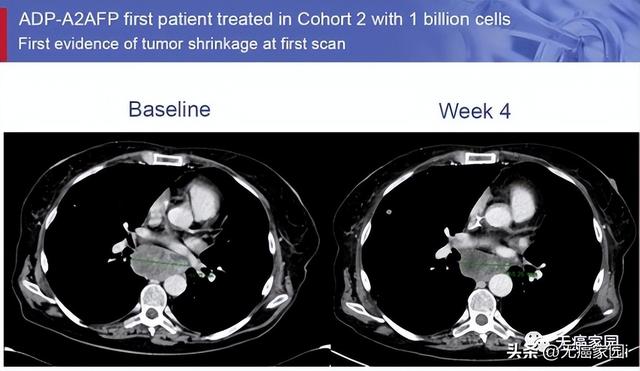
其他患者(隊列1、隊列2)最佳反應是病情穩定。隊列2中的1例患者在治療1個月後原發病竈體積未縮小,但縱膈淋巴結轉移竈體積明顯縮小!
因此,靶向AFP(甲胎蛋白)的TCR-T療法能夠殺死表達AFP的腫瘤細胞,基于此項研究的積極結果,研究人員有望將最大劑量擴大至50億個細胞治療,我們期待這項研究更新的數據公開!
目前正有一項研發的TCR-T療法在招募肝癌患者開展臨床試驗,想要參加的患者可以咨詢無癌家園醫學部了解詳細入排標准。
03
NK細胞治療
近兩年來,除了上述T細胞療法備受萬衆矚目外,另外一種新的癌症細胞療法——自然殺傷(NK)細胞療法也逐漸受到關注。研究人員說,NK細胞作爲一種細胞抗癌療法更具潛力,它可能會更安全、更便宜、更快速。
1、生存期超4年,NK療法讓肝癌患者胸腹水完全消失,腫瘤顯著縮小
對于NK細胞療法在肝癌治療領域的效果,無癌家園小編今天從一則刊登在《Oncotargets and Therapy》國外知名雜志上的NK療法治療晚期肝細胞癌患者的病例報告入手,給各位癌友們介紹下NK細胞療法的療效及安全性。
這位男性患者在2016年6月被診斷爲晚期彌漫性肝細胞癌,T3N1M1[即根據腫瘤-淋巴結-轉移(TNM)分期系統的IV期]。
從2017年3月~2018年7月,他完成了17個療程的NK細胞治療,每個療程每月進行一次,連續兩天輸注。值得一提的是,患者在NK細胞治療期間未接受其他治療。
經過17個月的治療後,該名患者的治療效果格外令人驚喜!
6個療程後,患者的胸水和腹水明顯減少。自治療結束以來,患者一直保持這種狀態。此外,在NK細胞治療17個療程後,右肝葉中的多個腫瘤體積減小。
值得一提的是,迄今爲主,該名患者的生存時間>48個月,即超過4年!
NK細胞治療前和治療期間的CT掃描結果
圖A1~A5:CT掃描顯示,6個療程後胸腔積液完全消失;
圖B1~B5:CT掃描顯示,6個療程後腹水幾乎完全消失;
圖C1~C5:CT:掃描顯示,肝右葉多個腫瘤的大小在17 個療程後顯著縮小;
2、疾病控制率達71.4%!NK細胞療法對抗肝癌殺傷力強勁!
最近一篇發表在《Journal of Modern Oncology(現代腫瘤醫學)》雜志上關于自然殺傷細胞治療肝癌的前瞻性研究中,來自暨南大學附屬複大腫瘤醫院腫瘤研究所的醫學者們對2016 年2月~2017年9月收治的17例肝癌患者進行了NK細胞免疫治療,向患者體內注射了在體外增殖的高活性NK細胞,並對患者病情進行了追蹤觀察和檢測。
治療結果令人驚喜!經NK細胞免疫治療後,所有患者的客觀緩解率爲14.3%,疾病控制率爲71.4%;從短期臨床療效上看,接受療程數多的患者療效稍好于接受療程數少的患者;且治療前後,患者均無不良反應出現,充分說明了NK細胞免疫療法的安全性、有效性。
04
CAR-NK細胞治療
CAR-T細胞療法取得的成功激發了人們對用CAR基因修飾NK細胞來增強其殺腫瘤能力的熱情。
CAR-NK就是利用基因工程給NK細胞加入一個能識別腫瘤細胞,並且同時激活NK細胞殺死腫瘤細胞的嵌合抗體。2020年,CAR-NK免疫細胞治療曾被權威學術期刊《自然-醫學》納入度生物醫學領域的十代矚目進展之一。
越來越多的體外和體內研究驗證了CAR-NK細胞對實體瘤的活性,其中大多數臨床前數據可用于胃癌、結直腸癌、肝癌、非小細胞肺癌、膠質母細胞瘤、乳腺癌、卵巢癌和胰腺癌。這些結果促成了首個用于實體瘤治療的 CAR-NK 細胞臨床試驗的啓動。
想尋求NK細胞療法或CAR-NK細胞療法及其他國內外治療新技術幫助,且經濟條件允許的情況下,患者可以先將病曆提交至無癌家園醫學部進行初步評估。
05
腫瘤浸潤淋巴細胞(TIL)治療
TILs療法,簡單點講就是將手術切除的腫瘤組織中的淋巴細胞分離純化,挑選出其中能特異性抗癌的淋巴細胞,擴增活化後回輸。這類療法擁有30多年的曆史,最早用于惡性黑色素瘤,近年來在宮頸癌、肺癌等多種實體瘤中都給出了不俗的數據。
這個療法相當于直接從戰場上拉回有戰鬥經驗的老兵,經過一輪“政治審查”和業務能力“大比拼”,把內奸、叛徒盡量剔除出去,留下戰鬥力最強的,提供補給,再重新送回戰場繼續戰鬥。
放眼整個行業,“基于TILS細胞的創新型療法LN-144(Lifileucel)預計在2022年獲批”的呼聲尤其大,TILs療法作爲“古老”的細胞療法有望在今年迎來首款獲批産品,其在治療實體瘤方面的巨大潛力不可小觑,實力強勁,較爲“出圈”。
若經濟條件允許且想咨詢TILs細胞療法可將病理報告及治療經曆、出院小結等資料提交至無癌家園醫學部,詳細評估病情。
06
樹突狀細胞疫苗
癌症疫苗是免疫療法的一種形式,通過刺激或恢複人體自身的免疫系統,來防止癌症發展或殺滅現有的腫瘤。
樹突狀細胞(DC)疫苗是近年來新興的一種生物治療惡性腫瘤的方法,已越來越受到腫瘤專家的關注和認可。作爲人體免疫防禦系統的重要成員,樹突狀細胞的抗原提呈功能最強,素有免疫系統的“哨兵”之稱,因其細胞向外延伸出許多樹枝狀的突起而得名。
它主要是通過應用現代的高科技生物技術,采集腫瘤患者的外周血,在體外短時間內誘導培養出大量的樹突狀細胞,並裝備上患者自身沒有的免疫細胞,精確“瞄准”並殺傷癌細胞。不僅如此,它還能在患者體內誘發免疫記憶,使患者獲得長期的抗癌效應。
07
CIK細胞療法
CIK細胞,即細胞因子誘導的殺傷細胞(Cytokine-Induced Killer,CIK)是一種新型的免疫活性細胞,CIK增殖能力強,細胞毒作用強,具有一定的免疫特性。由于該細胞同時表達CD3和CD56兩種膜蛋白分子,故又稱爲NK細胞(自然殺傷細胞)樣T淋巴細胞,兼具有T淋巴細胞強大的抗瘤活性,和NK細胞的非MHC限制性殺瘤優點。
如果說NK細胞是守護人體健康的“第一道防線”,那麽CIK細胞無疑就是殺傷腫瘤細胞的“精確導彈”。尤其對手術後或放化療後患者效果顯著,能消除殘留微小的轉移病竈,防止癌細胞擴散和複發,提高機體免疫力,因此,CIK 細胞被認爲是新一代的腫瘤過繼細胞免疫治療的首選方案。
08
CTL(細胞毒性T淋巴細胞)療法
對于廣大的無法手術的晚期癌症患者,什麽細胞療法可以作爲輔助治療呢?
近年來,針對這部分患者,研究者們一直在研發新的免疫治療方案,其中就有CTL(cytotoxic T lymphocytes)技術,即細胞毒性T淋巴細胞。該技術主要是利用癌細胞特有的、正常細胞上沒有或者含量很低的蛋白質做誘餌,把外周血中那“萬裏挑一”的真正能抗癌的淋巴細胞,挑選出來,然後在體外進一步改良和擴增,然後回輸給患者。
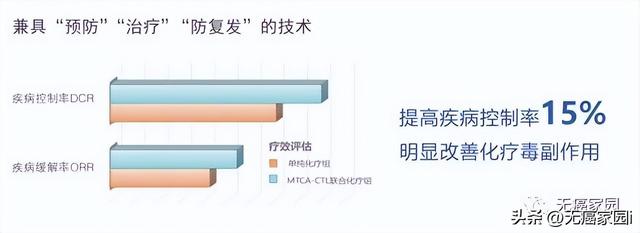
MTCA-CTL免疫療法是國內推出的新一代生物免疫治療模式。在保證非MHC限制性殺傷性NK-T細胞擴增的同時,定向擴增MHC限制性的CD8+特異性CTL細胞,使其在細胞産品中的比率可達到60%~70%。這種殺傷細胞的共同作用,使殺傷腫瘤細胞的效率更高。
【主要適用于實體腫瘤】頭頸部腫瘤、食道癌、肺癌、胃癌、乳腺癌、肝癌、膜腺癌、結亘腸癌、卵巢癌、子宮癌、彗癌、前列腺癌、惡性黑色素瘤、肉瘤、部分惡性淋巴瘤。
09
CAR-NKT療法
自然殺傷T細胞(NKT)是一群細胞表面既表達T細胞受體(TCR),又表達NK細胞受體的特殊T細胞亞群,能産生大量的細胞因子,例如IL-4和INFγ等。該類細胞既可以直接溶解殺傷腫瘤細胞,也可以通過間接途徑(分泌的細胞因子、激活的免疫細胞等)發揮抗腫瘤作用。
近期,由休斯頓的貝勒醫學院和德克薩斯兒童醫院共同開展的一期臨床試驗正在評估複發性神經母細胞瘤患兒的全新治療方–CAR-NKT細胞治療有望突破這一瓶頸。
I期代號爲GINAKIT2的試驗首次使用CAR-NKT細胞,治療複發性神經母細胞瘤。入組的11名患兒(1~21歲,平均年齡7歲)都是複發/難治性的高危神經母細胞瘤,腫瘤廣泛轉移並且臨床沒有更好的治療方案。
結果非常振奮人心:
11位晚期患者中,4例患者病情穩定,有2位達到部分緩解(腫瘤明顯縮小),其中1位接受第二次CAR-NKT細胞輸注後已完全緩解(CR)。
10
複合免疫細胞療法
此項技術同時將γδT細胞、NK細胞、NKT細胞、殺傷性T細胞、樹突狀細胞和輔助性T細胞等6種細胞進行活性化,把1000萬到2000萬個的細胞增殖到20~50億個,然後將其注入患者體內。將如此重要的免疫細胞同時進行培養,與單獨治療相比大大的提高了治療的效果。
除部分白血病、惡性淋巴瘤以外,可用于多數癌症的治療,在難以醫治的癌症類型及中晚期癌症中有很好的效果。
此外,複合免疫細胞對于提高免疫力、強身健體也起到很大的幫助。
本文爲無癌家園原創