能否喝上“頭道湯”, 開拓藥業需披露這款新冠藥的完整試驗數據
文 |《財經》記者 淩馨 辛穎 信娜
編輯 |王小
2022年4月6日,中國藥企開拓藥業(9939.HK)公布一項新冠口服藥治療輕中症非住院新冠患者的III期臨床試驗關鍵數據,稱該藥物可有效降低新冠患者住院率、死亡率。當日開盤,開拓藥業漲200%,截至收盤漲增收窄至106.37%。
這款藥物名爲普克魯胺,因其爲首家完成全球多中心臨床試驗的中國新冠藥物,而給予了資本市場想象空間。
開拓藥業相關人士對《財經·大健康》表示,將積極推進向中國、美國及其他國家和地區的國家藥物監管機構申請緊急用藥使用授權(EUA)許可,但目前暫無相關時間表,“剛公布數據,確實要一步一步做”。
普克魯胺在2021年12月末發布的III期臨床中期分析結果不佳,曾導致開拓藥業股價單日跳水70%。截至目前,開拓藥業尚未未公布III期完整數據。
一位一級市場投資人士向《財經·大健康》透露,國家藥監局藥品審評中心(CDE)將于4月組織相關企業會商,進一步推進國産新冠口服用藥研發上市的速度。“參照疫苗的做法,這些企業的策略都是繼續在中國做III期臨床,一邊申請緊急授權,兩條腿走路。”對此,CDE一位工作人員回應稱,暫未聽說這一消息。
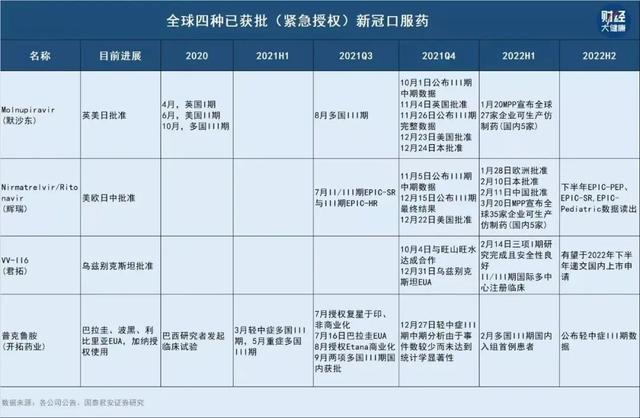
據《財經∙大健康》不完全統計,目前國內已有14款新冠口服藥在緊急研發中,除開拓藥業,君實生物、真實生物的口服藥也已進入III期臨床試驗。
究竟誰能成爲中國首款口服新冠藥,國産藥何時能上市?
未公布完整數據,還不好判斷?
深圳第三人民醫院院長盧洪洲牽頭普克魯胺在中國的一項臨床試驗,他告訴《財經·大健康》,深圳三院目前已經入組了數十例患者,已顯現出一定效果,主要包括新冠患者臨床症狀減輕、病毒核酸檢測結果轉陰等。
開拓藥業在4月6日發布的公告中稱,普克魯胺可改善新冠相關症狀,包括發熱、氣短、咳嗽,改善持續優于對照組到至少第28天。
相比對照組,730名用藥至少一天的受試者,普克魯胺組相應保護率爲50%;完成服藥大于一天的721名受試者中,與對照組相比,相應保護率爲71%;完成服藥大于七天的693名受試者中,普克魯胺組0住院,相應保護率爲100%。
普克魯胺在伴有高風險因素的受試者中顯現出一定效果。尤其是年齡≥60歲且伴有至少一個基礎疾病,如肥胖、糖尿病、高血壓等的受試者,普克魯胺組與對照組相比顯著降低住院/死亡率。
同時,相對于對照組,普克魯胺治療組從給藥第3天到第28天,可顯著持續降低新冠病毒載量。
不過,一位二級市場醫藥行業分析師則直言,“市場對現有公布數據還存有很多疑問。”
與已在國內上市的新冠口服藥輝瑞Paxlovid相比,普克魯胺目前公布的數據尚不完整,初步數據也略有差異。Paxlovid在2021年12月公布的數據稱,該藥將新冠患者的住院或死亡風險降低了89%(症狀出現後三天內)和88%(症狀出現後五天內)。
一位醫藥行業分析師向《財經∙大健康》介紹,“普克魯胺亞組數據還不錯,但如果沒有全人群達到三期主要臨床終點,不知道藥監局能不能批。”
普克魯胺入組患者爲733名,僅爲Paxlovid的三分之一,至試驗結束總體入院人數僅27人。“七天用藥對照組也只有六例住院,而且還沒公布患者總體用藥情況,這就很難排除偶然性,比如患者有沒有同時用其他的藥,有沒有打疫苗?”一位新藥研發業內人士稱,僅憑開拓藥業目前公布的數據,很難判斷其臨床試驗結果成功與否。
開拓藥業方面表示,隨著奧密克戎成爲全球主要流行株,新冠患者總體住院率和住院時間都在下降。比如他本來住院時間10天,變成五天、兩三天,在統計學上表現出的情況都有所不同。
開拓藥業創始人童友之在3月底召開的業績溝通會上承認,若要在住院時間改善方面表現出明顯的差異,“可能要用1000人”。
一位新藥研發人士判斷,更重要的問題是普克魯胺這次公布的試驗沒有篩選入組病人,輝瑞入組的都是高風險患者,更容易做出差異。“選擇入組高風險和重症患者,也需要企業對藥品的安全性有信心,否則入組太多重症症也會影響死亡患者比例。”
不過,他也指出,總體來說後來者的臨床試驗難度都會高于最早獲批的藥物,除了奧密克戎毒株感染後症狀本就較輕,全球普遍接種疫苗也讓高風險病人總體數量變少。
這位新藥研發人士認爲,在奧密克戎轉變爲主要流行株的背景下,臨床試驗的終點可以相應作出調整,“可以采用一些客觀數據,比如病毒載量的變化。如果企業能完整披露這一數據,對獲批肯定是有益的。”
開拓藥業在4月6日早間的電話會上表示,上述臨床試驗更詳細的CSR報告預計需要四至六周的時間整理,後續或考慮通過文章發表或學術會議等渠道進行披露。
走一條新技術路線,能否脫穎而出?
作爲全國新冠肺炎醫療救治專家組成員盧洪洲希望,國産新冠口服用藥加快上市進程。“今後一定還是以小分子口服藥爲主,它用起來更加方便,也會比進口的便宜”。
目前已有一款國産新冠用藥在中國獲批上市,是由騰盛博藥(2137.HK)生産的抗體類注射劑,深圳三院同樣參與了相關臨床研究。盧洪洲對比兩類藥物的效果稱,抗體類藥物若能早期使用,兩次後人體內病毒載量就可急劇下降,還能作用預防用藥,但生産成本較高,且需由醫護人員進行靜脈輸液。
“抗體需要冷鏈運輸,一旦在某個城市出現疫情暴發,運力未必能夠保障。”前述新藥研發人士進一步分析。
普克魯胺最早研發不是用于對抗新冠病毒,而是爲轉移性去勢抵抗性前列腺癌和轉移性乳腺癌治療的臨床開發,是一款新一代雄激素受體(AR)拮抗劑,也是ACE2和TMPRSS2降解劑。
開拓藥業在2021年6月公布的巴西臨床試驗數據稱,可將住院新冠患者的死亡率降低77%,平均住院時間縮短五天,被驚爲“神藥”將至。然而,同年發布的III期臨床中期分析結果顯示爲“由于事件數較少而未達到統計學顯著性”。
在2021年開拓藥業財報中稱,當年銷售收入達3423萬元,源自普克魯胺新冠適應症對外授權的首付款。同年4月,開拓藥業與華益泰康就擴大普克魯胺産能達成戰略合作;7月,與複星醫藥産業就普克魯胺治療新冠在印度和28個非洲國家的商業化達成合作協議。
開拓藥業的研發成本,由2020年的3.288億元,增加至2021年7.679億元,增長率133.5%。研發開支增加的主要原因是報告期內公司主導開展的三項普克魯胺治療新冠的III期全球多中心臨床試驗。
開拓藥業的技術路線,與目前全球新冠口服藥的兩大主要研發路線都不同,全球最先獲批的兩款新冠口服藥,默沙東的莫諾匹拉韋(molnupiravir)屬于核苷類藥物(RdRp),輝瑞Paxlovid屬于3CL蛋白酶抑制劑。
全球第一款獲得 EUA、唯一一款獲批上市藥物是瑞德西韋,是一種核苷酸類似物,和默沙東走的是同一條技術路線,但這款藥非口服藥。
除開拓藥業,目前國內新冠口服藥研發進度較快的,均爲RdRp路線,包括已經進入臨床III期試驗的君實生物和真實生物。
君實生物與蘇州旺山旺水生物醫藥有限公司(下稱“旺山旺水”)合作開發的口服核苷類抗新冠病毒藥物VV116,已于2021年底在烏茲別克斯坦獲批緊急使用,用于中重度新冠肺炎患者的治療。在中國,其全球多中心的III期臨床試驗在近期剛啓動。
真實生物的研發進度頗受地方政府關注。河南省平頂山市政府官微發布,2月28日,市委書記張雷明在會議上提到,真實生物公司研發的新藥“阿茲夫定”即將上市成爲抗新冠肺炎特效藥。
不過,目前輝瑞驗證的3CL是目前新冠口服藥最火的技術路線。就在1月14日,已有默德納等公司藥物上市的情況下,雲頂新耀宣布獲得新加坡實驗藥物研發中心(EDDC)研發的一組3CL蛋白酶抑制劑的全球獨家授權,用于治療新冠肺炎。
君實也宣布加入圍繞3CL的“賽跑”。在1月26日宣布旺山旺水合作,共同參與到靶向3CL蛋白酶的可口服抗新冠藥的競爭中。
同一賽道進度最快的先聲藥業(2096.HK),在3月30日公布,其新冠口服藥SSD8432獲國家藥監局批准進行臨床試驗。
一位新冠口服藥研發企業人士預計,國産3CL抑制劑新冠口服藥最快可能在2023年底上市。
從目前的研究進展看,君實生物和真實生物的兩款核苷類藥物與開拓藥業的普克魯胺都有望成爲中國進展最快的新冠口服藥。
前述一級市場投資人士猜測,也許企業會嘗試先申請EUA獲批,再補做大規模III期臨床試驗。“如果進一步數據不能驗證療效,CDE也可以隨時叫停”。
從2022年2月發布的《新冠病毒肺炎新藥臨床試驗技術指導原則 (試行)中》看,CDE最重視的還是輕型和/或普通型患者,發展爲重型/危重型的發生率或死亡率。
中國最需要的是一個有效、紮實的藥來抗擊新冠疫情。誰的臨床試驗結果能率先獲得CDE認可,誰就可能最快拿到中國市場的“入場券”。