文章來源:械企必讀(思宇MedTech旗下,專注産品注冊、市場准入等內容)
轉載要求:首發24小時後可轉載,需注明來源
在全球化的浪潮下,生物醫藥企業已將國際化拓展作爲重要戰略。覆蓋近6.7億人口的東南亞,預計將在2030年成爲全球第四大單一市場。該地區吸引了衆多藥械企業的目光,全球最頂級制藥和生物科技公司如艾伯維(AbbVie)、諾華(Novartis)、輝瑞(Pfizer)、羅氏(Roche)、賽諾菲(Sanofi)、雅培(Abbott)等陸續在新加坡建造生産基地,並且深耕東南亞市場。
新加坡完善的法規保障,清晰的審批路徑,較大的確定性,這些條件是醫藥企業快速推進創新藥械臨床研究及進入市場的保證。新冠疫情中, 企業在新加坡衛生科學局(HSA)的審批依然有序推進。
受美國白宮生物法案(法案內容可參考“械企必讀”往期文章《 》)的影響,“出海東南亞”再一次成爲醫療創投圈裏最熱的話題。新加坡或許會成爲國內藥械企業布局出海東南亞的最受青睐之地!
本文重點介紹新加坡醫療器械市場准入流程、周期及費用。
01
新加坡醫療器械定義及分類
(1)醫療器械定義
在新加坡,“醫療器械”是指單獨或組合使用,用于人類如下一個或多個特定目的的任何儀器、器材、機器、器具、植入物、體外試劑、校准器、軟件、材料或其他類似的物品:
1)診斷、預防、監測、治療或減輕任何疾病;
2)損傷的診斷、監測、治療、緩解或賠償;
3)解劑或生理過程的研究、替代、調節或支持;
4)支持或維持生命;
5)妊娠控制;
6)醫療器械的消毒:
7)通過對取自人體的樣本進行體外檢查的方式來提供醫療信息。
(2)醫療器械分類
在新加坡,醫療器械大致分爲:常規醫療器械和體外診斷器械(IVD) 兩大類;按安全風險高低,又分爲A、B、C、D四個類別。
1)新加坡常規醫療器械分類
2)新加坡體外診斷醫療器械分類
02
新加坡醫療器械監管機構
在新加坡,醫療器械的監管機構是新加坡衛生科學局(Health Sciences Authority, HSA)。HSA 成立于2001年4月,隸屬于新加坡衛生部(Ministry of Health (MOH) Singapore) ,是負責監管西藥、醫療器械、輔助健康産品、化妝品等産品的新加坡法定機構。HSA享用行政執法權,也擁有一般科研機構或事業單位的獨立權和靈活性。
在制定醫療器械的監管框架時,HSA參考了發達國家的醫療器械監管系統,包括美國食品和藥物管理局(FDA) 、歐盟公告機構(EU NB)、加拿大醫療器械局(MDB)、日本衛生勞動福利部(MHLW)和澳大利亞治療用品管理(TGA)等機構,並結合自身情況,摸索出一套適應新加坡情況的醫療器械監管體系。
03
新加坡醫療器械注冊
1.新加坡實行與國際接軌的醫療器械分類管理制度,即按安全風險將醫療器械分爲A、B、C、D類共4個類別進行管理。
2.根據新加坡《健康産品法令》及《健康産品(醫療器械)條例》的規定,除了豁免産品,所有類別的醫療器械産品都必須經過HSA注冊方可在新加坡上市銷售。
3.注冊人或申請人必須是一家新加坡注冊公司,注冊人或申請人須通過HSA的醫療器械信息與通訊系統(MEDICS) 在線提交申請。凡是經過注冊的醫療器械,都列入新加坡醫療器械注冊清單(SMDR) 中,消費者可在線查詢所購買的醫療器械是否經過注冊。
4.非無菌A類醫療器械可以免除注冊,但該類醫療器械仍需符合醫療器械安全與性能的基本要求,不得與相關法律法規相抵觸。無菌A類醫療器械(含體外診斷器械)仍需進行注冊。部分B類、C類和D類醫療器械如果已經獲得美國、歐洲、澳大利亞、日本上市批准,在提供相關證明文件後,可加快注冊甚至立即注冊。
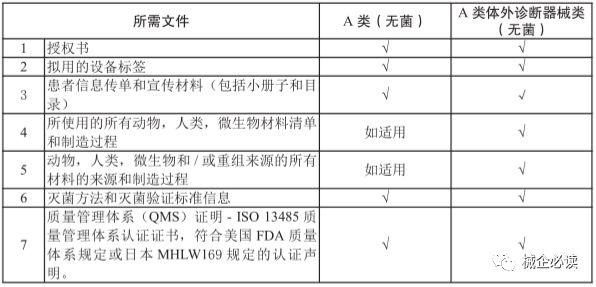
(1)無菌A類醫療器械注冊
1)注冊流程

3)注冊周期和費用無菌A類醫療器械的注冊人或申請人提交申請資料時,需支付申請費約25新元,HSA在30個工作日內對注冊資料進行審核並作出決定。
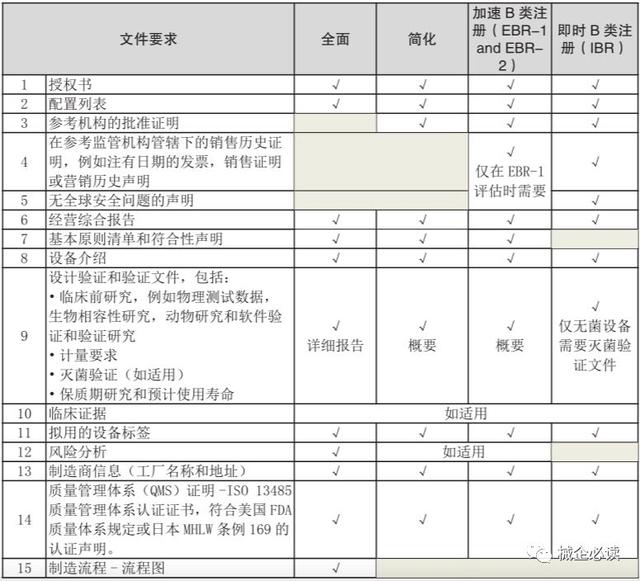
(2)B類醫療器械注冊
1)B類醫療器械評估路線分類注冊前,需對B類醫療器械進行評估,分爲四條評估路線:全面評估路線、 簡化評估路線、加速B類注冊(EBR)評估路線、即時B類注冊(IBR)評估路線。
2)B類醫療器械不同評估路線需提交的文件
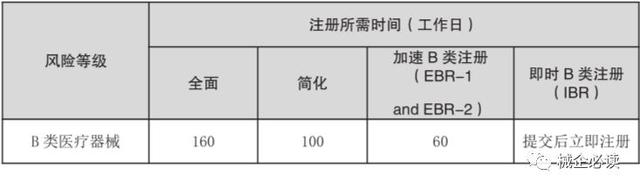
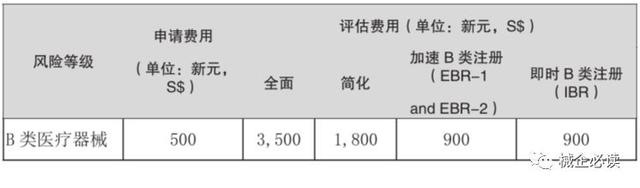
3)B類器械注冊周期和費用
(3)C類/D類醫療器械注冊1)C類/D類醫療器械評估路線分類
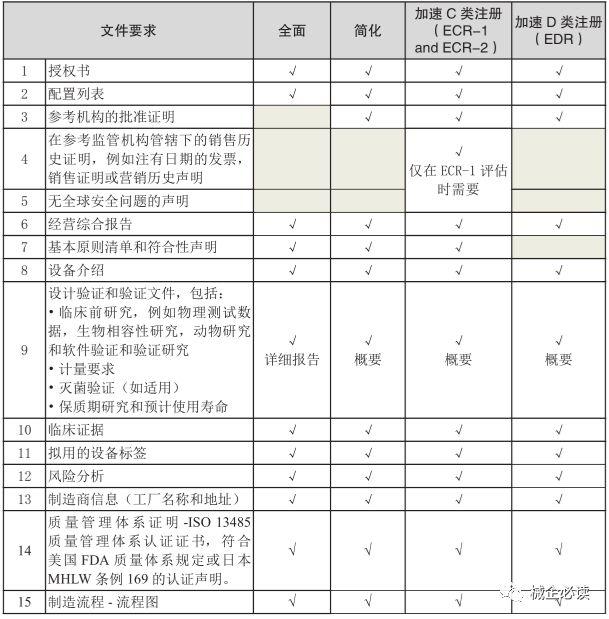
2)C、D類醫療器械各評估路線所需提交的資料
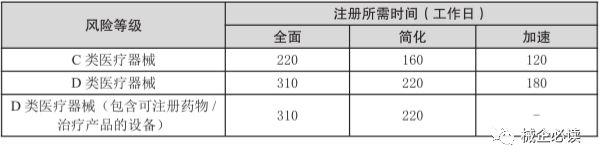
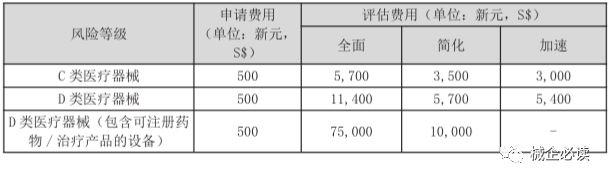
3)C、D類器械注冊周期和費用
參考資料:何麗欽. 新加坡醫療器械市場准入解讀[C]//.第十四屆中國標准化論壇論文集.,2017:1266-1274.