CAR-T(嵌合抗原受體T細胞)技術是目前最有發展前景的腫瘤免疫細胞治療手段之一。目前它主要應用于血液系統惡性腫瘤,如急性淋巴細胞白血病、慢性淋巴細胞白血病等。但在實體瘤的治療應用上,效果欠佳。
患急性淋巴細胞白血病的21歲迪拜女孩麥吉,在輾轉迪拜、新加坡、印度、菲律賓等國治療,骨髓移植後再次複發。
絕望之際來到中國,接受CAR-T免疫療法。回輸了,經基因工程技術改造過的,自體能識別並殺滅腫瘤的CAR-T細胞,最終戰勝了白血病。
麥吉的經曆再一次印證了利用CAR-T治療血液系統腫瘤的有效性。
在我們爲此鼓掌歡呼的同時,也産生了一個疑問:CAR-T免疫療法在實體瘤上的應用效果如何呢?
CAR-T治療實體瘤的挑戰
回顧近二十年實體瘤治療技術的發展:
1990年前,治療技術基本以放化療爲主;
1990到2010年,小分子靶向藥開始成熟;
從2010年起,免疫治療開始嶄露頭角。
我們可以看到,以CAR-T爲代表的細胞免疫治療時代已經來臨,但實體瘤卻是它目前的“勁敵”。
CAR-T面臨的挑戰包括:
▪ 靶點
目前CAR-T治療實體瘤的已知靶點主要有21個,其中最普遍的問題是CAR-T治療帶來的副反應——脫靶效應。
就是正常細胞也會表達腫瘤相關抗原(TAA),從而發生排斥反應。
▪ 有效性
腫瘤微環境(TME)存在多種抑制信號,抑制效應T細胞的作用。
此外,CAR-T在在持續抗原刺激下會變得反應遲鈍,最終失去效應功能。
▪ 産業化
複雜的制備工藝和高昂的生産成本是CAR-T商業化的最大障礙。
CAR-T更好“戰車”,有望消滅實體瘤
實體瘤區別血液瘤的一個關鍵點是——微環境。
首先,CAR-T細胞靜脈注射後,很難進入到腫瘤組織中並大量擴增。
其次,即使能進入腫瘤組織,CAR-T細胞也因爲腫瘤微環境中免疫抑制因子、營養失衡等因素難以增殖並發揮殺傷功能。
但近日在《Nature》子刊上的一篇文章,給業界帶來了希望。
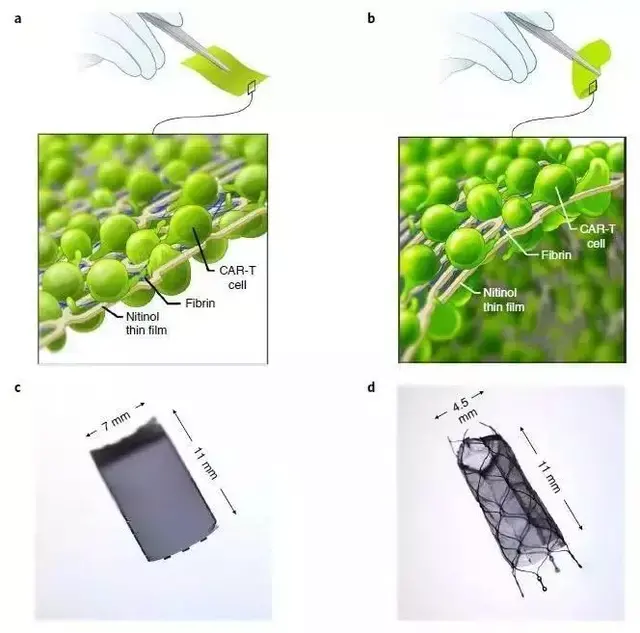
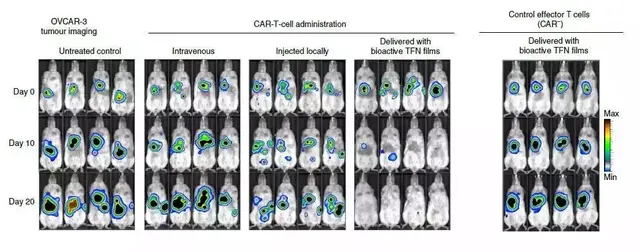
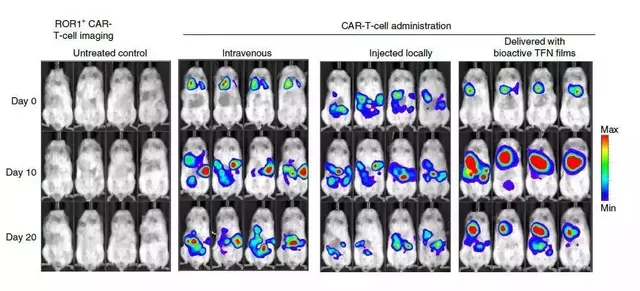
原來,弗雷德·哈欽森癌症研究中心的一項研究表明,在卵巢癌的臨床前模型中,包埋于鎳钛薄膜的CAR-T細胞可以縮小腫瘤,有望擺脫CAR-T細胞治療實體瘤的困境。
在小鼠模型中,研究人員將靶向腫瘤抗原ROR1的CAR-T細胞包埋于上述鎳钛薄膜中,並植入被卵巢癌細胞侵襲的小鼠隔膜處。
在第20天,70%的小鼠腫瘤完全消失。
而且,對T細胞的生物發光成像表明,包埋于鎳钛薄膜中的CAR-T在腫瘤部位擴增232倍。
這是靜脈注射的500多倍,是瘤內注射的800多倍。
該研究設計的這種鎳钛薄膜是一個高度靈活的系統,對免疫細胞殺傷腫瘤具有定位和支撐功能。
通過對結構、形狀、細胞因子等因素的設計,可用于多種實體瘤的細胞治療。
除了這種生物材料上的創新,斯坦福大學醫學院的研究人員也向外宣稱,找到了T細胞耗揭的關鍵原因。
在再生醫療工具與理論上的雙重推進,將有望幫助我們在臨床上消滅實體瘤。
————————-
END
【華夏源生命庫】
你關心的也正是我們關注的