(報告出品方/分析師:華安證券 譚國超)
1 專注眼科用藥市場,産品管線布局全面
1.1 四十余年專注眼科用藥市場,鑄就興齊創新眼藥龍頭
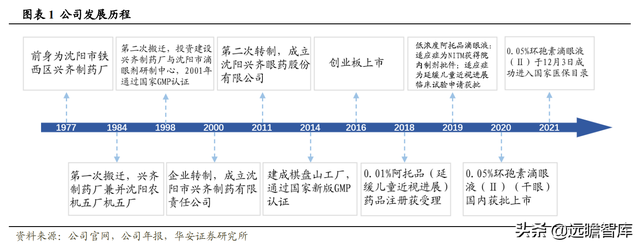
公司前身爲沈陽市鐵西區興齊制藥廠,建立于1977年。
2000 年,沈陽市興齊制藥有限責任公司正式成立。曆經11年,公司進行企業第二次改制,成爲沈陽興齊眼藥股份有限公司,並于2016年在創業板上市。
公司成立多年來專注于眼藥的研發、生産和銷售,主要産品爲眼科處方藥物,覆蓋眼科藥物十個細分類別;在研管線布局全面,覆蓋幹眼症、近視、結膜炎、黃斑水腫、青光眼等疾病。重磅産品0.01%硫酸阿托品滴眼液(延緩兒童近視進展)的藥品注冊申請于 2018 年獲得國家藥監局受理,目前正開展Ⅲ期臨床試驗,有望成爲全球首批。
0.05%環孢素滴眼液(Ⅱ)(幹眼症)于 2020 年 6 月獲批上市,且已被納入國家醫保目錄(2021 年版),是國內首個獲批上市的治療幹眼症的環孢素眼用制劑。
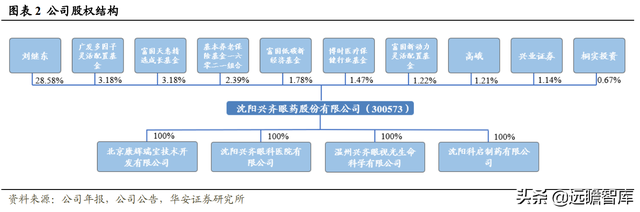
公司股權結構穩定,控股股東、實際控制人爲劉繼東先生。
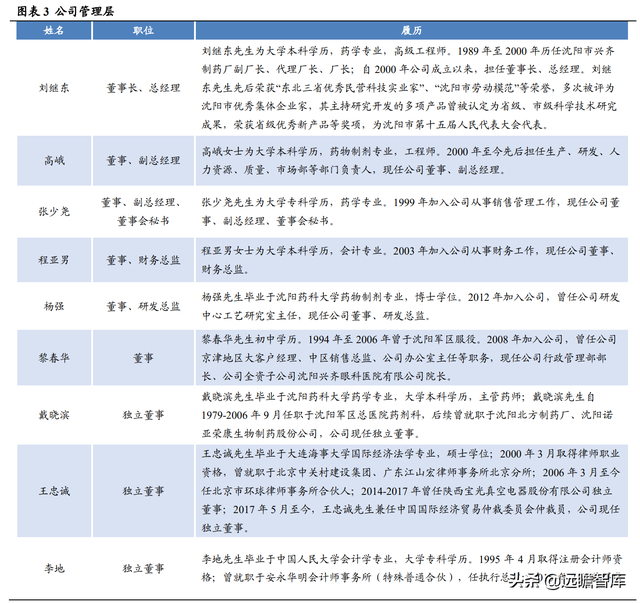
劉繼東先生是公司董事長、總經理,持股比例28.58%,是公司第一大股東。
劉繼東先生爲大學本科學曆、藥學專業,高級工程師,其主持研發的多項産品獲得多種成果認定和榮譽。全資子公司沈陽興齊眼科醫院(有限公司)主要開展醫療服務,運營良好。
興齊眼科醫院于2017年注冊成立。
2018年,興齊眼科醫院獲得硫酸阿托品滴眼液(降低近距離工作引起的短暫性近視(“NITM”))的院內制劑批件(規格:0.4ml:0.04mg)。
2019年12月,互聯網醫院正式成立。患者可以就地就醫,通過上傳本地的病例、檢查單和處方,等待互聯網醫院醫生審核通過後遠程購買藥品。
2020年3月,興齊眼科醫院幹眼治療中心成立,並陸續整合了視光中心、設立視功能康複訓練中心等科室。
2020年6月,興齊眼科醫院獲遼甯省衛生健康委員會審批“基因檢驗實驗室二級生物實驗室”備案成功,並具有新型冠狀病毒核酸檢測資質。
2020年8月,興齊眼科醫院的醫保等級提升,成爲“沈陽市醫保市二級定點醫院”。
1.2 成熟市場産品力強,研發投入推進多項新藥研發項目
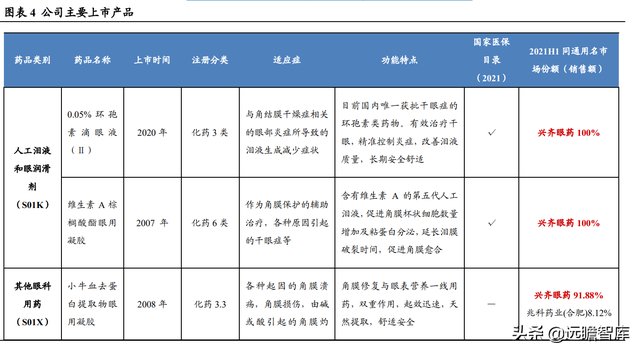
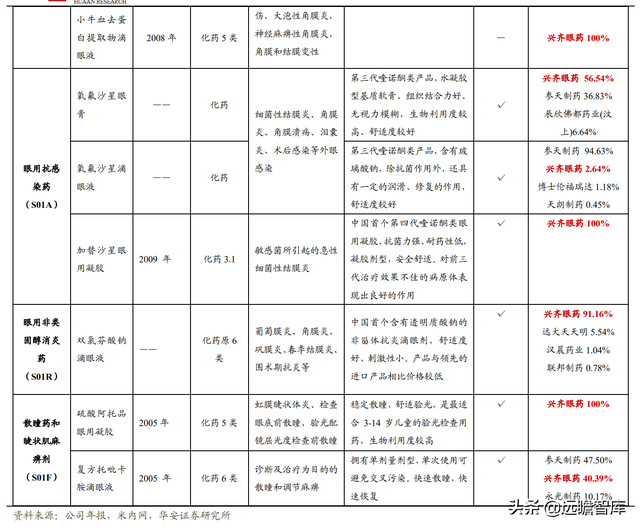
公司已構建“系列多、品種全”的眼科藥物産品體系,覆蓋眼用抗感染藥、營養與角膜修複藥等其他眼科用藥、眼用非類固醇消炎藥、人工淚眼和眼潤滑劑等十項眼科藥物産品細分類別。
公司擁有眼科藥物批准文號 51 個,其中 29 個産品被列入國家醫保目錄(2021 年版),6 個産品被列入《國家基本藥物目錄》。
成熟市場産品力強,主要上市産品銷售格局好。
根據2021年H1樣本醫院銷售數據,0.05%環孢素滴眼液、維生素 A 棕榈酸酯眼用凝膠、小牛血去蛋白系列等産品在同通用名市場中擁有絕對的銷售優勢,競爭格局極好。
氧氟沙星眼膏市場中,興齊眼藥占據 56.54%的市場份額,參天制藥爲 36.83%。
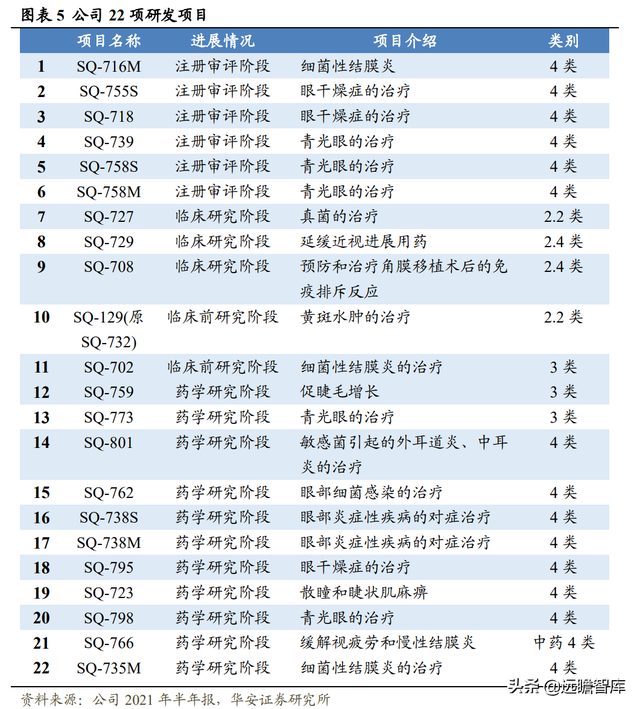
公司打造豐富、多樣化的在研産品管線,目前共有 22 項研發項目,6 項處于注冊審評階段,3 項處于臨床試驗研究。
其中化藥 2.4 類改良型新藥 0.01%阿托品滴眼液(延緩近視進展)處于Ⅲ期臨床試驗階段,研發進度全球領先。
另有兩款化藥 2 類新藥他克莫司混懸滴眼液(角膜移植術後的免疫排斥反應)、伏立康唑滴眼液(真菌性角膜炎)也處于臨床研究階段。公司先進研發中心和專業研發團隊助力在研管線持續推進和拓展。
公司研發中心爲遼甯省興齊眼科藥物工程技術研究中心、遼甯省省級企業技術中心。
經過多年發展,公司研發中心已擁有眼用凝膠等七個工藝技術平台及質量研究、藥理研究、藥代動力學研究三個評價技術平台,同時設有臨床醫學部、注冊審評部等覆蓋眼科藥物研發各階段的職能部門。
目前,公司擁有發明專利 36 項。2020 年,公司研發人員共 121 名,較 2019 年增加 8 名。
公司始終堅持自主研發,持續加大研發投入。
2020 年、2021 年 H1 研發投入分別爲 8,356 萬元(+51.35pct)、4,914 萬元(+47.69pct),分別占營業收入 12.13%、10.63%。
2020 年資本化研發支出占研發投入 24.37%。2017-2020 年,公司研發費用率一直保持在 9%以上,2021 年前三季度研發費用率 8.08%,全年有望突破 2 位數。
1.3 疫情影響逐漸消除,業績穩步增長
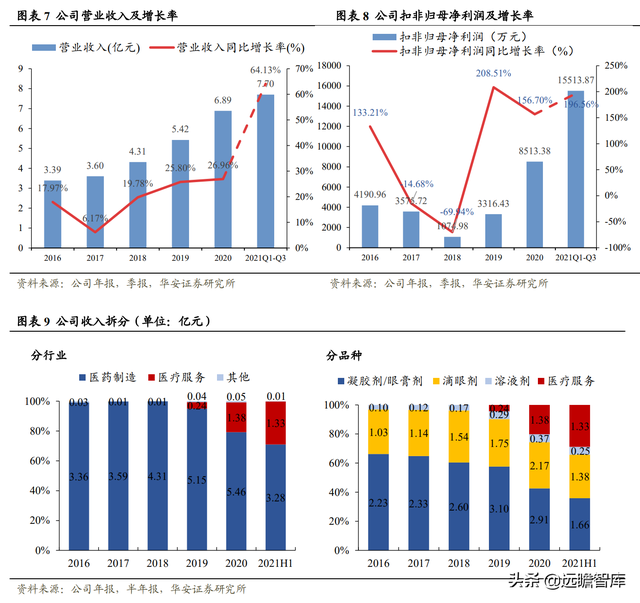
營收和扣非歸母淨利潤持續增長,醫療服務貢獻更多收入。
2021 年前三季度營業收入持續增長至 7.70 億元,同比增長 64.13%,扣非歸母淨利潤 1.55 億元,同比增長 196.56%。
2021 年 H1 醫療服務創造收入 1.33 億元,占比 28.79%,同比增長 254.99%。同期,醫藥制造營業收入爲 3.28 億元(+67.85pct),占比 80%。
醫藥制造中占比最大的凝膠劑/眼膏劑營業收入 1.66 億元(+51.67pct),占比第二大的滴眼劑營業收入 1.38 億元(+84.81pct)。
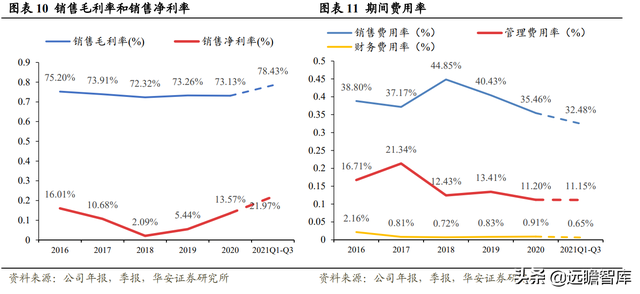
銷售毛利率和淨利率保持增長態勢,銷售費用率呈下降趨勢,公司支出管控得當。
2021年前三季度銷售毛利率高達 78.43%,淨利率爲 21.97%。銷售費用率自 2018 年逐年降低,2021年前三季度下降至 32.48%。
管理費用率和財務費用率保持穩定比例,分別維持在 11%左右和 1%以下的水平。
2 0.01%阿托品滴眼液:開拓近視眼藥新藍海,多因素驅動未來收入增長
興齊眼藥的 0.01%硫酸阿托品滴眼液用于延緩近視進展,目前正處于Ⅲ期臨床階段,相比于其他防治近視手段成本更低、療效更好,使用風險更小。
該産品研發進度遙遙領先,有望成爲全球首批,加之興齊眼科醫院互聯網醫療的優勢,未來的市場潛力無限,有望達到 32 億元以上的市場規模。
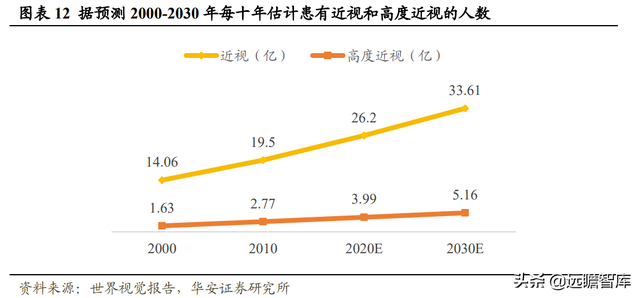
2.1 近視高發,藥物治療市場需求增加,全球近視率不斷攀升。
根據 WTO 發布的《世界視覺報告》,全球所有年齡的近視患者將增至 2030 年的 33.61 億人,通常伴隨嚴重並發症的高度近視人數將增至 2030 年的 5.12 億人。
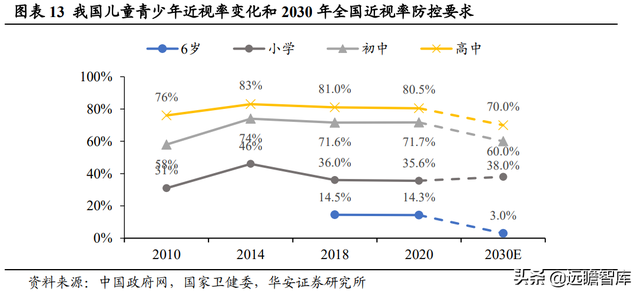
中國已成爲世界第一近視大國,青少年近視率高。
2020 年我國總體近視率爲 52.7%,近視患者已超過 7 億人次。青少年近視率居世界第一,20 歲以下近視人口近 1.7 億人,且青少年高度近視比例呈上升趨勢。
北京大學中國健康發展研究中心《信息化時代兒童青少年近視防控報告》研究數據顯示,2021 年,我國兒童青少年近視的患病率已超 60%,未來至少有 9.6 億近視人口。
若無有效遏制,我國未來將至少有 11 億近視人口。
按照患者基數計算,近視成爲國內眼科領域內第一大疾病。
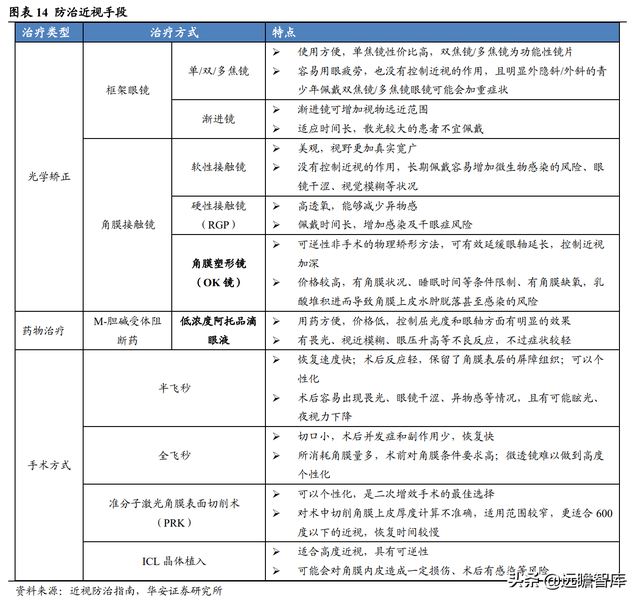
目前針對近視的防治手段有半飛秒、全飛秒等近視手術,光學矯正和藥物治療等非手術方式。
近視手術價格昂貴,術後需要恢複期。
光學矯正中的 OK 鏡(角膜塑形鏡)有延緩近視進展的作用,不過價格較高,且有一些條件限制。
低濃度阿托品滴眼液能夠控制近視,且使用方便,價格較低,逐漸受到各界關注。
無論是全球還是中國,高發病率的近視疾病、稀少且昂貴的有效現存防治手段將帶來防治近視的眼藥巨大的市場規模。
預防近視上升至國家戰略,助力拉動眼科醫療需求。
近年政府頻頻出台有關眼保健康的政策,有利于民營眼科醫院的設立和運營,促進醫學時光業務的發展和覆蓋。
其中,《綜合防控兒童青少年近視實施方案》提出,到 2030 年,6 歲兒童近視率控制在 3%左右,小學生近視率下降到 38%以下,初中生近視率下降到 60%以下,高中階段學生近視率下降到 70%。
2.2 關鍵臨床數據支持 0.01%阿托品的療效優勢和安全性
阿托品爲非選擇性 M-膽堿受體阻斷藥,在臨床上有廣泛的應用,如擴瞳、麻醉 前給藥等。科學家早在1900年就開始使用阿托品來抑制調節反射從而延緩近視加深。
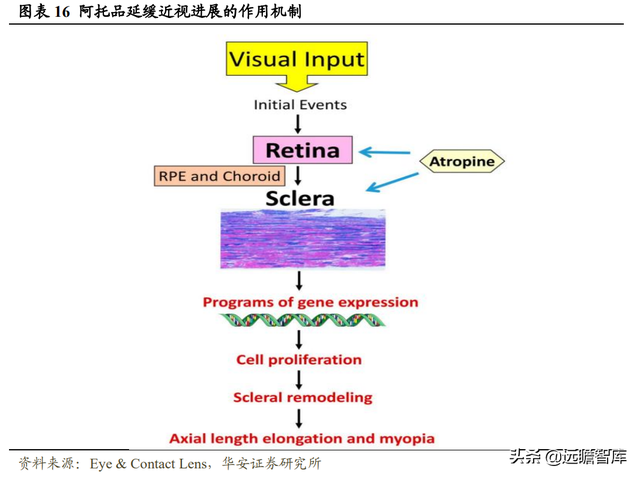
阿托品延緩近視進展的效果已被證實,但是具體作用機制尚不明確。
早期睫狀肌調節機制假說認爲阿托品通過松弛睫狀肌而起調節作用。
目前主流學術界質疑這種調節機制,認爲阿托品能直接或通過多巴胺等介質間接作用于視網膜、鞏膜或脈絡膜的 M1 或 M4 受體,進而引起鞏膜纖維層變薄、軟骨層增厚,即鞏膜重塑,從而控制眼睛軸向生長。有研究認爲阿托品最有可能與視網膜上的 M4 受體結合。
不同濃度的阿托品對近視延緩的效果不同。
0.01%阿托品滴眼液在有效延緩近視進展的同時,反彈效應更弱,且安全性良好。
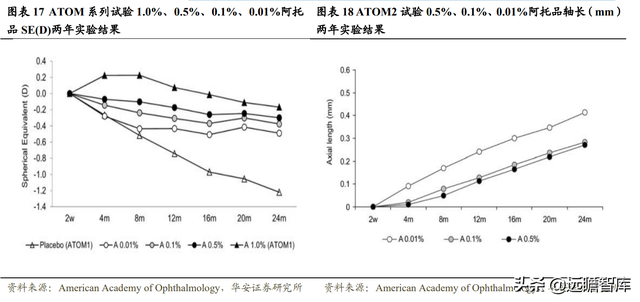
較爲著名的相關研究爲新加坡國家眼科中心、新加坡眼科研究所 ATOM 系列試驗。ATOM2 試驗進行了兩階段研究。
一階段研究:高濃度阿托品延緩近視進展的效果更好,但是停藥後反彈效應更大,安全性也不及 0.01%阿托品。
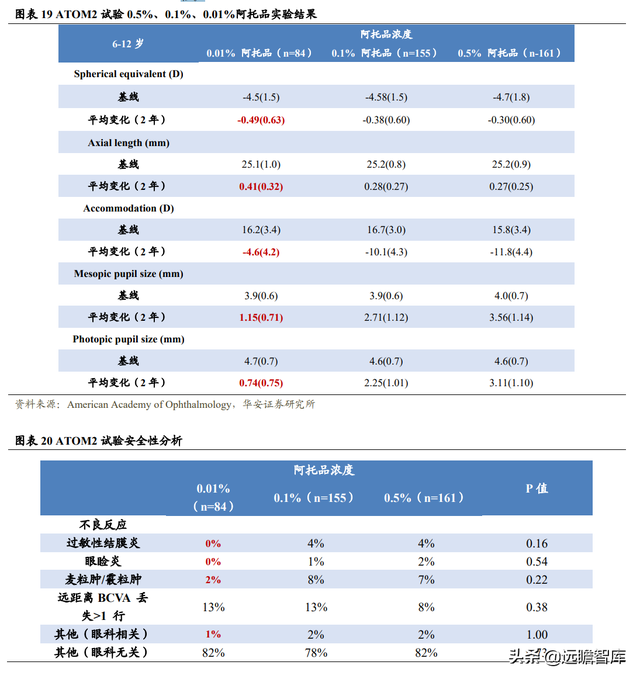
實驗將 0.01%、0.1%、0.5%的阿托品滴眼液分別作用于 400 名 6-12 歲的患者並進行兩年治療,結果顯示 0.5%、0.1%和 0.01%近視緩解程度分別爲 75%、70%和 60%。0.5%阿托品滴眼液延緩近視進展的效果最佳。
在瞳孔大小、調節力的影響以及不良反應發生率方面,0.01%阿托品均表現出更高的安全性。
0.01%阿托品滴眼液的調試幅度僅減少 4.6D,而 0.1%、0.5%阿托品滴眼液減少幅度分別達 10.1D、11.8D,進一步說明 0.01%組的近視力沒有明顯受損,而其他兩組存在缺陷。
無論是明視覺還是暗視覺條件,0.01%阿托品滴眼液僅使得瞳孔大小增加 1mm 左右,而 0.05%和 0.1%能夠增加 3mm 左右。
0.01%阿托品的副作用更小,不良事件發生比例小。
使用 0.01%阿托品的患者沒有發生過敏性結膜炎、眼睑炎,其他的不良反應發生比例均比 0.1%、0.5%的阿托品要低,呈現出較好的安全性。
兩年後停止用藥 1 年:曾經使用過 0.5%、0.1%阿托品患者反彈分別爲 0.9D、 0.8D 左右,且後期發展快,而 0.01%阿托品反彈大約 0.3D,反彈效應並不明顯。
研究第二階段:0.01%阿托品滴眼液顯示良好效果。
將 0.01%阿托品重新作用于 1 年洗脫期內近視進展>0.5D 的患兒,爲期 2 年。結果顯示重新接受治療的患者近視進展得到了良好控制。0.01%阿托品 5 年近視進展不超過-1.4D,而安慰劑組在第 2.5 年便進展至-1.4D。
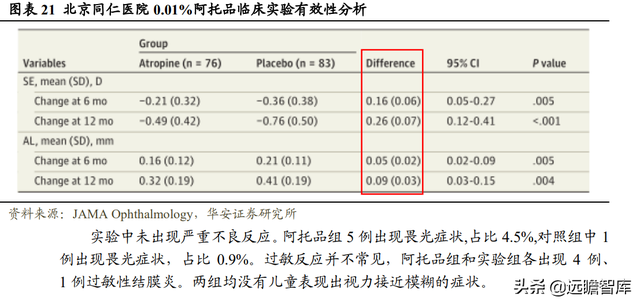
北京同仁醫院曾用興齊眼藥研制的 0.01%阿托品滴眼液開展過該滴眼液控制近視進展的臨床試驗,是中國大陸第一個證明 0.01%阿托品滴眼液療效的隨機、雙盲、安慰劑對照試驗。
實驗對象爲 2018 年 4 月至 7 月在本院就診的 6 至 12 歲雙眼 SE 在 -1.00D 至-6.00D 範圍內的 220 例近視兒童,以 1:1 比例分配至 0.01%阿托品組和安慰劑組。
研究結果顯示,阿托品組相比于安慰劑組,SD 平均減少 0.26(0.07)D,減少比 例爲 34.2%,軸長減少 0.09(0.03)mm,減少比例爲 22.0%。
2.3 0.01%阿托品滴眼液爲最可靠的近視防治手段,藥品競爭格局極好
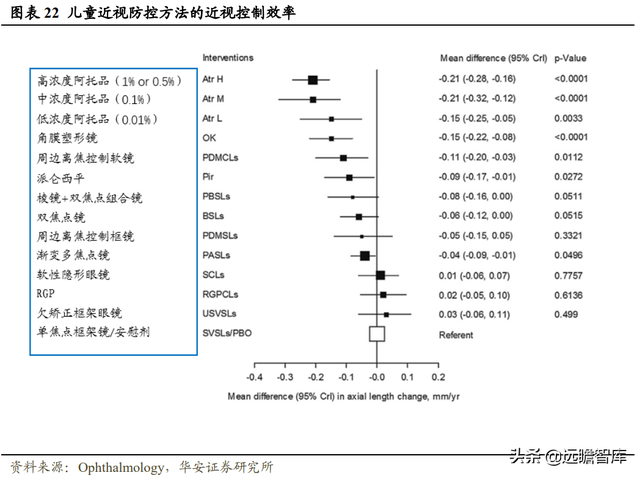
現存近視防治手段中,阿托品滴眼液控制眼軸增長的效果最爲明顯,其次爲 OK 鏡。
溫州醫科大學黃錦海團隊于 2016 年證實過該結論,研究結果表明,以眼軸長度變化爲指標進行排序,近視控制效率排名前五的分別爲高、中、低濃度阿托品、OK 鏡、周邊離焦控制軟鏡。
相比于高濃度阿托品滴眼液,0.01%阿托品滴眼液在有效延緩近視進展的同時,表現出反彈效應弱、安全性高的優勢,臨床上也常使用 0.01% 阿托品滴眼液,因此 0.01%阿托品滴眼液爲最可靠的近視防治手段。
0.01%阿托品滴眼液和 OK 鏡聯合治療效果更佳,發揮協同效應。
大連醫科大學第二附屬醫院曾開展由興齊眼藥研制的 0.01%阿托品、OK 鏡和兩者聯合控制近視的臨床療效對比的前瞻性、隨機、對照研究。
試驗納入 67 名兒童,分別將 22 名、 24 名、21 名患者隨機分至 SA 組(佩戴眼鏡並使用 0.01%阿托品)、0K 組(僅使用 OK 鏡)、OKA 組(聯合使用 OK 鏡和 0.01%阿托品)。研究顯示,AL 和 SFChT 呈負相關關系。
12 個月後,OKA 組的 AL 伸長的減少最大,SA 組次之。OKA 組的 SFChT 變化最大,其次爲 OK 組。
0.01%阿托品與 OK 鏡配合使用對 AL 伸長的控制作用和 SFChT 的增加作用最大。
長期佩戴 OK 鏡會增加對角膜上皮的機械刺激,可能造成角膜持續缺氧,引發無氧代謝反應,致使眼球滲透壓上升,易引起角膜水腫。
阿托品的使用將減少物理刺激,避免滲透壓上升和角膜水腫。同時,阿托品能夠松弛睫狀肌,促進細胞內神經遞質釋放,進而增加淚膜的穩定性,減少佩戴的不適感。
目前國內並無獲批上市和商業化的 0.01%阿托品滴眼液,僅能憑“院內制劑”的身份在院內開方使用,經藥品管理部門批准後可跨院或跨省間調劑使用。
興齊眼藥于 2019 年 1 月拿到 0.01%阿托品滴眼液(近距工作誘導的短暫性近視)的院內制劑注冊批件。
除了興齊眼藥,愛爾眼科和山東眼科醫院等低濃度阿托品滴眼液也拿到院內制劑批件。
興齊眼藥憑借院內制劑獲批早的優勢,盡早投入使用並優先提升品牌知名度。同時,患者可通過興齊眼科的互聯網醫院上傳當地就醫所開的處方、病例等多項材料並經線上醫生審核通過後遠程購買藥品,這將有利于低濃度阿托品滴眼液的的銷售。
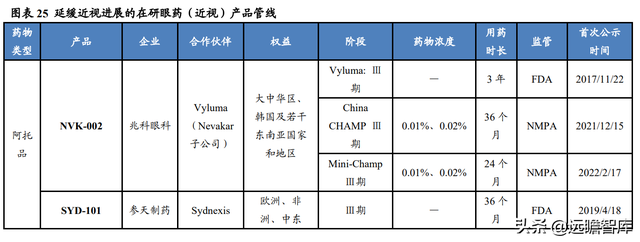
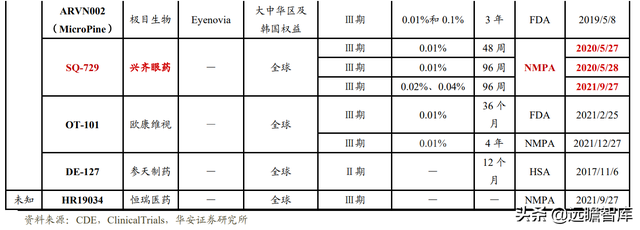
興齊眼藥在研進程遙遙領先,有望成爲全球首批。
目前全球範圍內尚無延緩近視進展的低濃度阿托品滴眼液獲批上市。
主要競品 Vyluma(兆科眼科)的 NVK-002 在歐美地區開展的Ⅲ期臨床試驗預計于 2022 年底完成,2023 年向 FDA 申報 NDA, 國內的 China CHAMP、Mini-Champ 兩個Ⅲ期臨床試驗申請也已于 2021 年底獲批。
Sydnexis(參天制藥)的 SYD-101、Eyenovia(極目生物)的 ARVN002 以及參天制藥的 DE-127 在美國或新加坡的Ⅲ期臨床試驗正在進行中。
歐康維視的 OT-101、恒瑞醫藥的 HR19034 在國內的Ⅲ期臨床試驗剛剛開始。而興齊眼藥早在 2020 年便開展Ⅲ期臨床試驗,進度領先,更有可能成爲全球首批,在時間上取勝。
2.4 0.01%阿托品滴眼液銷售規模有望達到 32 億元以上
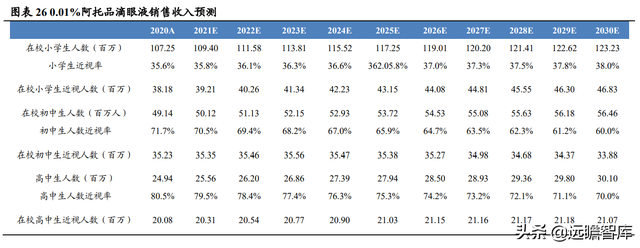
測算興齊眼藥的 0.01%阿托品滴眼液銷售峰值爲 32.05 億元,測算基于以下假設:
(1)假設在校小學生、初中生、高中生人數的 CAGR 分別爲 1.40%、1.40%、1.90%,到 2030 年人數分別增長至 1.23 億人、0.56 億人、0.30 億人;
(2)假設 2030 年小學生、初中生、高中生近視率均達到國家近視防控要求:38%、60%、70%,預測期內逐年遞減;
(3)假設興齊眼藥的 0.01%阿托品滴眼液于 2023 年獲批上市;2023 年延緩近視進展的阿托品類藥物滲透率爲 0.15%,到 2030 年增長至 2.30%;2023 年興齊眼藥的 0.01%阿托品滴眼液滲透率爲 0.15%,到 2030 年增長至 1.04%;
(4)假設 1 個月使用一盒(30 支/盒,一支/天),用藥時長爲 1 年,藥品 298 元/盒,每年用藥費用按照 2%逐年遞減。
基于以上假設,測算 2023 年兒童青少年近視總人數可達 9,767 萬人,0.01%阿 托品滴眼液滲透率爲 0.12%,銷售收入 4.11 億元,預計于 2030 年達到銷售峰值 32.05 億元,滲透率爲 1.04%。
3 0.05%環孢素滴眼液:爲幹眼病治療更佳選擇,國內首家獲批上市
興齊眼藥的茲潤0.05%環孢素滴眼液用于治療幹眼症,爲國內首家且唯一獲批上市。
近期該産品被納入2021版國家醫保目錄,醫保支付標准爲5.5元(規格:0.4ml:0.2mg/支)。
0.05%環孢素滴眼液具有優良的療效和安全性,並采用獨家Ailic-Tech創新技術,相比于原研藥 Restasis 有更高的用藥依從性和生物利用度;加之其納入醫保的優勢和時間優勢,未來有望達到 17 億元以上的市場規模。
3.1 幹眼病市場規模巨大,環孢素滴眼液迎來春天
我國幹眼病發病率逐年上升。幹眼病是眼科門診第一常見眼病,並往往伴隨內分泌相關疾病。2020年中國幹眼病患者約爲 2.19 億人口。
根據《國人幹眼多中心大數據報告》,幹眼患者人數以每年 10%以上的速度上升。43-86 歲人口中有 21.6%患有幹眼病,65 歲以上人群中幹眼患病率爲 75%。
經常使用視頻終端者幹眼發病率高達 93%、佩戴隱形眼鏡患者患病率爲 90%。
環孢素滴眼液迎來春天。
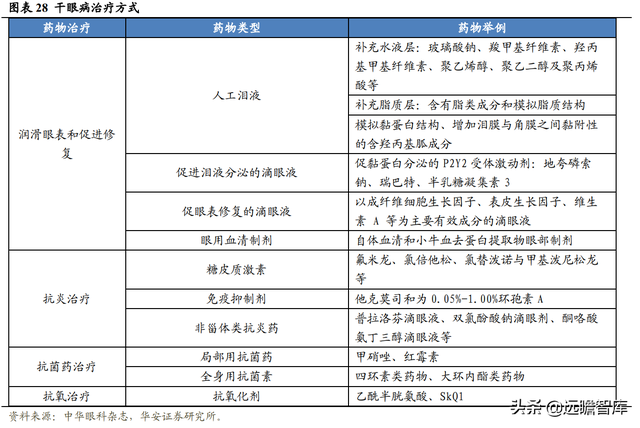
目前國內可用的治療方案種類和效果有限,主要爲人工淚眼和糖皮質激素。
人工淚眼可以長期給藥,但是治標不治本,對于中重度患者作用不大,並且通常含有化學防腐劑。
糖皮質激素在發揮抗炎作用的同時也抑制了機體正常的保護機制,長期、反複使用會引起青光眼、白內障、眼部機會性感染等一系列並發症,不適用長期給藥。
這兩種主流治療方式在作用機制和治療效果上有明顯的局限性。而環孢素滴眼液作爲一種免疫抑制劑,既可達到對幹眼症進行精准抗炎的療效,又能促進淚液和黏蛋白分泌,滿足患者因反複發作導致的長期用藥需求。
環孢素滴眼液將會是我國規模日益增長的幹眼病患者群體的首選良藥。
我國幹眼病市場規模巨大。
根據灼識咨詢報告,受新藥的上市和患者池擴充的影響下,幹眼病藥物的市場規模預計以 30.25%的複合增長率大幅增長至 2030 年的 67 億美元。
3.2 0.05%環孢素滴眼液源于國外,高于國外
興齊眼藥的茲潤于 2020 年 6 月獲批上市,用于與角結膜幹燥症相關的眼部炎症所導致的淚液生成減少症狀。該産品的原研藥 Restasis 已在其他國家上市。
T 細胞介導的免疫失調是造成幹眼和炎症持續的關鍵。
0.05%環孢素滴眼液能精准抑制 T 細胞活化和炎症因子的釋放,防止結膜上皮細胞凋亡,誘導活化 T 細胞凋亡,並維持眼睛的免疫平衡。
興齊的 0.05%環孢素滴眼液具有優良的有效性和安全性。
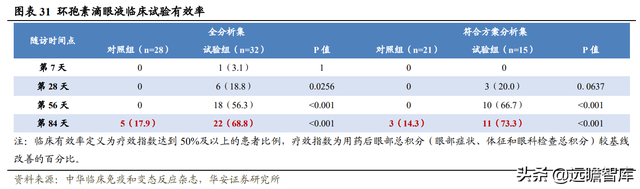
北京協和醫院曾開展一項産自興齊眼藥的 0.05%環孢素滴眼液(Ⅱ)治療幹燥綜合征相關中重度幹眼的有效性和安全性:隨機、雙盲、安慰劑對照亞組研究,爲期 84 天。
試驗共納入 60 例患者,試驗組 32 例,每天給予 2 次 0.05%環孢素滴眼液(Ⅱ);對照組 28 例,每天給予溶劑 2 次。
兩組同時使用滴用人工淚眼(羟丙甲纖維素滴眼液)每天 3 次作爲基礎治療。
研究結果顯示,試驗組和對照組臨床總有效率分別爲 68.8%和 17.9%(P< 0.001)。試驗組在第 28 天及以後各隨訪時間點顯現統計優效。
本試驗未發生嚴重不良事件。
試驗組發生中度眼痛 2 例(6.3%),對照組發生輕度眼痛 1 例(3.6%)。
大多數受試者用藥後眼部無不適感,第 84 天時,試驗組和對照組滴藥後各有 1 例産生不適感。
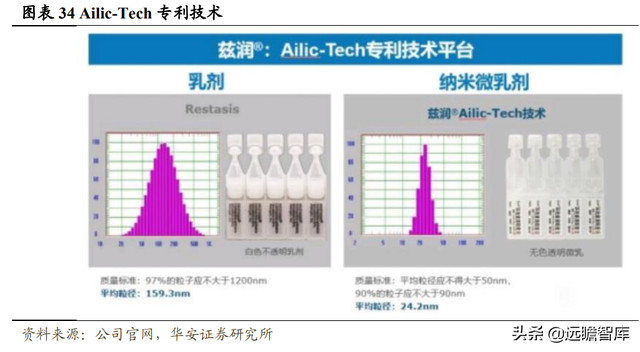
興齊的 0.05%環孢素滴眼液使用獨家 Ailic-Tech 創新技術,比 Restasis 更加舒適安全。
興齊茲潤爲納米微乳劑,規定平均粒徑不得大于 50nm,90%的粒子應不大于 90nm,平均粒徑爲 24.2nm。Restasis 爲乳劑,規定 97%的粒子應不大于 1200nm,平均粒徑爲 159.3nm。
粒徑越大,越容易産生異物感和燒灼感。而興齊茲潤的粒徑小,更加舒適,尤其是對于中重度幹眼患者,用藥依從性和生物利用度會提升。
3.3 國內唯一獲批的治療幹眼症的環孢素類藥物,競爭格局良好
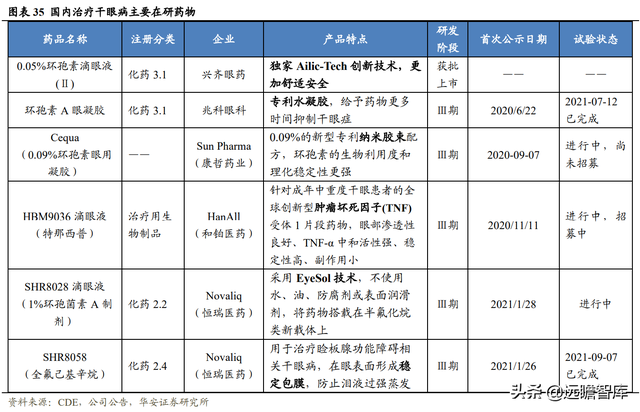
興齊眼藥的 0.05%環孢素滴眼液爲國內首個獲批,主要競品有兆科眼科的環孢素 A 眼用凝膠,該藥物Ⅲ期臨床試驗已于 2021 年 4 月完成,采用專利水凝膠,專利權已在中國至國際範圍獲批。
此創新藥方能提升環孢素 A 于眼表的藥物代謝動力學效能及曝露量,給予藥物更多時間抑制幹眼症。且每晚僅一次給藥,提升患者的遵醫囑性和生活質量。
含有環孢素成分的藥物還有康哲生物的 Cequa、恒瑞醫藥的 SHR8028 的滴眼液,分別采用納米膠束配方和 EyeSol 技術提升生物利用度,均處于Ⅲ期臨床階段。
恒瑞醫藥的化藥 SHR8058 滴眼液(全氟己基辛烷)的Ⅲ期臨床試驗已于 2021 年 9 月完成,和鉑醫藥的生物制品 HBM9036 滴眼液(特那西普)目前正處于Ⅲ期臨床階段。
興齊眼藥的 0.05%環孢素滴眼液競爭格局良好:
➢ 爲國內首家獲批上市的治療幹眼症的環孢素類藥物,主要競品均處于臨床試驗階段,興齊擁有絕對的時間優勢;
➢ 大量臨床數據證明 0.05%環孢素滴眼液的優良療效以及安全性,且已成爲醫生的主選治療方式之一;
➢ 相比于原研藥 Restasis 采用獨家 Ailic-Tech 創新技術,有更高的生物利用度;
➢ 已被納入國家醫保目錄並于 2022 年開始實施,未來兩年內將會實現迅速放量。
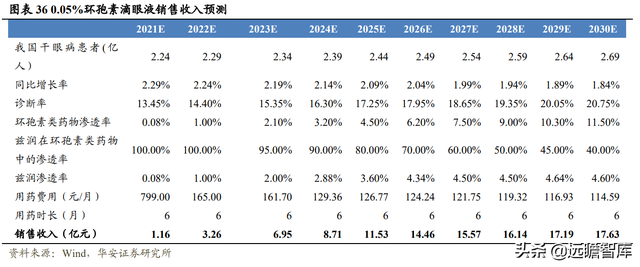
3.4 0.05%環孢素滴眼液銷售規模有望達到 17 億元以上
測算茲潤銷售峰值爲 17.63 億元,測算基于以下條件:
(1)假設我國幹眼病患者以 2%的 CAGR 增長至 2030 年 2.69 億人;
(2)假設診斷率從 2020 年 12.50%逐年增長至 2030 年 20.75%;
(3)假設治療幹眼症的環孢素類藥物 2021 年滲透率爲 0.08%,增長至 2030 年 的 11.50%,茲潤滲透率從 0.08%增長至 4.60%;
(4)假設一個月使用一盒(30 支/盒,一支/天),用藥市場 6 個月;進入醫保前中標價格爲 799 元/盒,2022 年正式實施醫保價格 165 元/盒。
2023 年協議到期,假設公司續約,2024 年降價幅度爲 20%。其余年份的用藥費用以 2%逐年遞減。
基于以上假設條件,測算 2021 年我國幹眼症患者可達 2.24 億人,茲潤滲透率爲 0.08%,銷售收入 1.16 億元,預計于 2030 年達到銷售峰值 17.63 億元,滲透率爲 4.60%。
4 業績預測與估值
4.1 公司業績預測
(1)0.05%環孢素滴眼液:
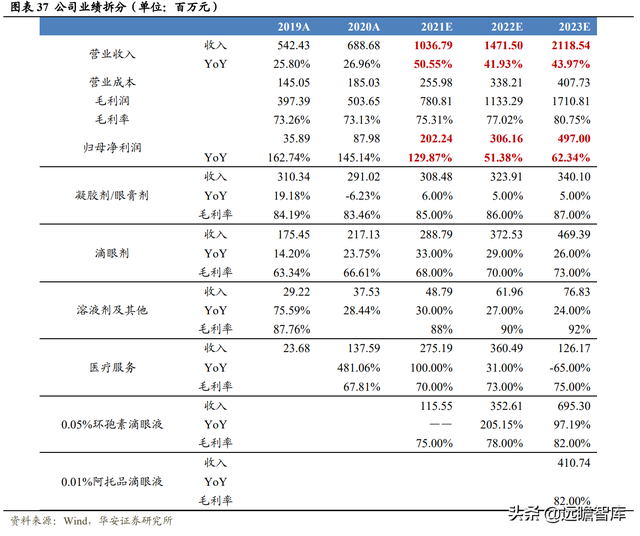
仍爲目前國內唯一被批准上市的治療幹眼症的眼藥,且已被納入國家醫保目錄,未來兩年內實現快速放量,預計 2021 年、2022 年、2023 年銷售收入分別爲 1.16 億元、3.53 億元、6.95 億元;
(2)0.01%阿托品滴眼液:
用于延緩兒童青少年近視進展的新藥,預計 2023 年獲批上市,上市後第一年將會帶來銷售收入 4.11 億元;
(3)公司其他産品和服務:
公司原有産品力強,未來三年將保持穩步增長,預計 2021 年、2022 年、2023 年凝膠劑/眼膏劑收入增長速度爲 6%/5%/5%,滴眼液收入(不包括茲潤和 0.01%阿托品滴眼液)增長速度爲 33%/29%/26%,溶液劑及其他産品收入增長速度爲 30%/27%/24%,醫療服務前兩年收入增長速度爲 100%/31%。
綜上,我們預計公司 2021 年、2022 年以及 2023 年營業收入分別爲 10.37 億元、14.72 億元、21.19 億元,分別同比增長 50.55%、41.93%、43.97%;歸母淨利潤分別 爲 2.02 億元、3.06 億元、4.97 億元,分別同比增長 129.87%、51.38%、62.34%。
4.2 估值
可比公司估值
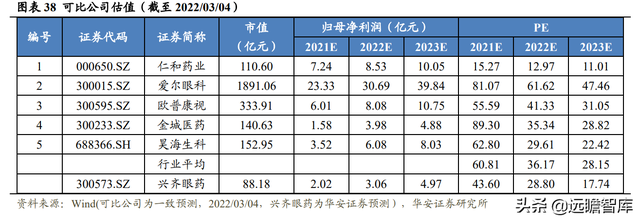
基于公司的主營業務領域爲眼科疾病,並且是國內眼科藥物研發、生産、銷售領域的龍頭企業,選取包括仁和藥業、愛爾眼科、歐普康視、金城醫藥、昊海生科作爲可比公司進行估值比較。
截至 2022 年 03 月 04 日,可比公司 2021-2023 年平均 PE 爲 60.81X/36.17X/28.15X。公司估值低于可比公司平均水平。
DCF 法估值 用 DCF 估值法對環孢素滴眼液、阿托品滴眼液以及其他産品和服務進行市值估 計。
假設永續年金增長率爲 3.0%,WACC 爲 8.50%,阿托品上市成功概率爲 85%,最終得到公司合理市值爲 149.53 億元。
風險提示:
(1)藥品推廣風險:成熟産品推廣存在增速放緩的可能性,新興産品進入市場需要一定的導入期,若推廣不及預期則業績會受到一定影響。
(2)新藥研發和審批風險:試驗結果分析不明確、審批流程和周期等均有不確定性,若研發進度不及預期則未來新藥的創收能力將會具有不確定性。
(3)醫藥政策波動風險:醫藥行業受政策影響大,醫保降價、集采降價、申報流程等政策因素可能會造成藥品的注冊和銷售的不確定性。
—————————————————————
請您關注,了解每日最新的行業分析報告!
報告屬于原作者,我們不做任何投資建議!
如有侵權,請私信刪除,謝謝!
獲取更多精選報告請登錄【遠瞻智庫官網】