澎湃新聞首席記者 賀梨萍
一個成年人體內大約有37.2萬億細胞,對這些生命的基本單位,人類至今還沒有像掌握基因“密碼本”一樣,擁有一份來自細胞的全“圖譜”。“這個細胞總數是一個巨大的數字,但對人體細胞分類,以及對細胞各自功能的研究,對人類疾病治療非常重要。”
近日,深圳華大生命科學研究院劉龍奇在接受澎湃新聞(www.thepaper.cn)記者專訪時表示,現階段而言,人類細胞圖譜的全面解析仍存在多項挑戰,他們近年來將目光聚焦到和人的基因相似度高達93%的食蟹猕猴(Macaca fascicularis)。來自6個國家的35個科研團隊首次展示了這一非人靈長類動物(NHP)的大規模細胞轉錄組圖譜。
該研究于4月13日晚間在線發表于頂級學術期刊《自然》(Nature),題爲“非人類靈長類猕猴的細胞轉錄組圖譜”( Cell transcriptomic atlas of the non-human primate Macaca fascicularis)。研究由深圳華大生命科學研究院聯合北京華大生命科學研究院、深圳國家基因庫、吉林大學、中國科學院廣州生物醫藥與健康研究院、瑞典卡羅林斯卡醫學院、英國劍橋大學、西班牙ICREA研究所、新加坡ASTAR等來自6個國家的研究團隊聯合完成。
“這個圖譜就像一張‘地圖’,有了它就相當于有了一個探索生命細胞分辨率的高精度儀器,可以‘看到’每個器官都有哪些細胞,還可以精細到每個細胞裏具體的分子特征及與其他細胞的互作關系。”該論文第一作者、深圳華大生命科學研究院韓磊博士介紹說,“這爲我們更好地認識生命的基本結構,探究疾病和細胞的關系打下了基礎,也爲疾病的精准治療提供了新的方向。”
中科院腦科學與智能技術卓越創新中心主任蒲慕明院士也分析了此項研究在生物學和應用上的重要意義。他認爲,作爲臨床藥物研發重要的模式動物,未來五到十年,食蟹猴各種疾病模型將不斷出現。“今天獲得的數據就是一個最好的基礎,是藥物研發最好的數據庫,是非常重要的一個裏程碑。”
值得關注的是,研究團隊還搭建了非人靈長類動物百萬單細胞的資源網站NHPCA (https://db.cngb.org/nhpca/)。該數據庫開放且具有交互式特征,劉龍奇對澎湃新聞記者表示,“可以實現用戶自行探索,也可以實現用戶數據和我們數據的整合。”
他強調,上述理念非常重要,也是未來細胞圖譜領域的大趨勢。“在未來細胞圖譜體量越來越大的情況下,如何整合不同平台、不同實驗室的數據是非常重要的。而如何把數據庫建得更好,本身也是一個很重要的學問。”
深圳華大生命科學研究院劉龍奇博士。
人類細胞圖譜挑戰
攜帶著遺傳物質的細胞,我們如何窺探其奧秘?把細胞放置在顯微鏡下,可以觀察到其形態和結構,然而科學發展至今,科學家們想在分子水平上解析細胞與細胞之間的細微差別。
單細胞測序技術的出現爲深入“閱讀”細胞帶來了前所未有的機會。2009年,湯富酬(現任北京未來基因診斷高精尖創新中心研究員、北京大學生命科學學院BIOPIC中心教授)在博士後期間即發表了世界上第一篇單細胞mRNA測序的文章,實現了“從0到1”的跨越。這次重要的嘗試開啓了單細胞轉錄組測序的時代。
而近年來,高通量單細胞測序技術的發展也催生了“人類細胞圖譜”(Human Cell Atlas)的提出。該計劃提出之初主要由英美科學家主導,2017年10月,美國麻省理工學院-哈佛大學博德研究所的計算生物學家Aviv Regev、英國威康信托桑格研究所細胞遺傳學負責人Sarah A. Teichmann在論文預印本平台bioRxiv發表了一篇文章,文章標題即爲“The Human Cell Atlas”,系統論述了HCA的意義、目標、任務和實施路徑。而在公開發表該文章的近一年之前,Regev等人在英國倫敦已召開了一次關于該計劃的會議。
浙江大學醫學院幹細胞與再生醫學中心教授郭國骥此前在接受澎湃新聞(www.thepaper.cn)記者采訪時表示,作爲生命科學領域近年來興起的國際大科學計劃,“人類細胞圖譜計劃旨在描述人體中每個細胞的詳細特征,呈現不同類型細胞在人體組織的3D結構,勾勒所有人體系統的相互聯系,揭示圖譜變化與健康和疾病的關系。人類細胞圖譜計劃將徹底改善人們對疾病的理解、診斷和治療。”
此前的2020年3月,郭國骥等人在《自然》發表了一項研究成果,他們對60種人體組織樣品和7種細胞培養樣品進行了Microwell-seq高通量單細胞測序分析,系統性地繪制了跨越胚胎和成年兩個時期,涵蓋八大系統的人類細胞圖譜。郭國骥彼時表示,這項研究工作構建了人類細胞圖譜的基本框架,對未來圖譜的進一步完善具有指導性意義。
然而,截至目前,人類細胞圖譜的構建仍充滿挑戰。劉龍奇對澎湃新聞記者表示,“其中最大的挑戰就在于當前工具的通量和成本,這也是最直接的難點。”如果按照商業工具來算,測一個細胞的成本爲幾塊錢,“對37萬億個細胞進行測序的成本是非常高的,不可能支撐。”
成本帶來的限制還在于,相比于1990年正式啓動的人類基因組計劃(HGP),人類細胞圖譜計劃當前並沒有固定的經費支持,“人類基因組計劃相對來說經費比較固定,而人類細胞圖譜計劃現在是由各個科學家籌集經費,這一點帶來很大的挑戰。”
第二點挑戰則在于項目目標不是特別明確。“組織相對自由,每個人有自己的研究計劃,不同人的分工可能也很難做到很明確,當前都是大家根據各自感興趣的方向來做。”劉龍奇認爲,整體而言,人類細胞圖譜計劃目前還沒有做到明確的目標和任務分工。
第三大挑戰還在于各實驗室之間的“壁壘”。“目前這個階段,不同的實驗室使用的工具可能會有差異,最終的結果是給大家之間的數據共享和分析挖掘帶來不同的挑戰。”這也源于當前整個該領域的工具還沒有非常成熟。
自主可控的工具先行
劉龍奇所在的深圳華大生命科學研究院主導的這項最新研究先將目光投向了和人的基因相似度高達93%的食蟹猕猴。
研究團隊在論文中寫道,考慮到進化上的接近性,非人類靈長類動物(NHPs)代表了最接近人類的選擇。構建一份非人類靈長類動物細胞圖譜(NHPCA)將産生一份可用于研究人類生理、疾病和衰老的特征目錄。這也將爲人類和非人類靈長類動物之間不同身體功能的進化機制提供洞見。
當然,非人類靈長類動物也包括一個龐大而多樣的物種群體,它們在生態、飲食、運動和行爲方面都有很大的差異。鑒于更頻繁的生殖周期、更廣泛的分布等特點,特別是食蟹猕猴,其在全球常被用于以科研爲目的的研究。
劉龍奇也表示,“從基因組序列來看,猕猴和人的差異相比小鼠等模式動物要小很多,這是選擇猴的第一個原因;第二,如果想真正了解人類的疾病,比如帕金森、阿爾茲海默症等,你不能在人身上直接做研究,我們必須構建動物疾病模型,非人靈長類尤其在認知和神經系統疾病研究中具有顯著優勢。”
劉龍奇談到,目前這類數據較少,猕猴還是一個空白,“所以這些數據的發布對于未來進行一系列的研究都非常重要,包括疾病機制理解、藥物篩選等。”
單細胞建庫系統DNBelab C4。
這項研究中的所有實驗都使用了單細胞建庫系統DNBelab C4,以及DNBSEQ系列測序平台。劉龍奇認爲,在成本太高難以支撐的情況下,“工具突破是首先必須要解決的問題。”
DNBelab C4即由華大智造自主研發,于2019年10月正式對外發布。此外華大智造自主擁有DNBSEQ系列測序平台,“我們在構建細胞圖譜時已經有了非常顯著的優勢,從上遊的建庫到下遊的測序,在工具上已經全面掌控了。”
DNBSEQ測序平台。
而如何從組織器官分離到細胞圖譜産生?劉龍奇介紹道,對于用單細胞核RNA測序(snRNA-seq)分析的樣本,采集後首先被保存至液氮(-190℃)中,直至進行細胞核提取。用密度梯度離心法獲得較純的細胞核,單細胞(核)懸液制備好後,通過DNBelab C4,細胞核被包裹成液滴,在液滴中完成細胞裂解及微珠捕獲mRNA,有效回收微珠後,在單管中完成反轉錄、cDNA合成,根據高通量測序流程制備文庫並進行測序及生信分析。
“其實單細胞工具做的就是一件事,給每個單細胞核打上一個DNA標簽,就像二維碼一樣,打完標簽的細胞放到一起,我們就可以進行下一步的建庫和測序。測完序之後我們根據標簽去區分每個細胞,通過這樣的過程我們就可以生成一個細胞圖譜。”劉龍奇進一步形象地解釋道。
這項研究中一處令人關注的細節是,少數組織樣本采用了過去常用的單細胞RNA測序(scRNA-seq)技術,而大多數組織則采用了單細胞核RNA測序(snRNA-seq)進行圖譜分析。
劉龍奇解釋稱,“首先,雖然大部分mRNA是在細胞質裏面,但是mRNA是從細胞核裏面轉錄出來,細胞核裏面依然有很多的mRNA,所以從理論上來說這是可行的。”
另一個關鍵的原因在于單細胞核RNA測序對樣本處理“非常友好”。劉龍奇提到,這項研究涉及到45個器官和組織,大多器官的樣本解離上策略不一,針對每個細胞需要進行方法優化,而且當研究人員在分析全細胞的時候,一個器官裏面細胞大小有差異,“比如肝,肝實質細胞較大,免疫細胞又非常小,所以在組織解離的過程中,按照傳統的方法很容易丟掉一些細胞。”另外,基于液滴包裹技術的單細胞工具對于細胞大小較爲敏感,“大的細胞很難包裹,小的細胞比較容易包裹,這些都會帶來非常明顯的偏好性。”
總體來說,細胞核大小幾乎固定,在1微米左右,這一點消除了數據的偏好性。此外,無論多少個器官,研究團隊可用統一的方法去分離提取,因此也消除了樣本處理帶來的影響。“我們把這些影響降到最低。”當然,對胰腺這樣的組織,本身也難以分離出高質量的細胞,較爲穩定的細胞核是唯一選擇。
對于骨髓這樣的遊離細胞,研究團隊仍然采用了單細胞RNA測序。“骨髓的細胞整體來說非常小,提核相對來講比其他組織難度大一點,但是分離細胞非常容易。”
據劉龍奇介紹,對于單細胞測序和單細胞核測序,研究團隊進行了系統的分析,“有些細胞我們既做了細胞又做了細胞核,從全局角度來看,它們的一致性大概是在90%-95%之間。但是,當你看單個基因的時候,可能細胞跟細胞核在某些基因表達上有差異。”
研究團隊認爲,這項研究的結果也證實了單細胞核RNA測序用于生成大規模細胞圖譜的實用性。
全球首個非人靈長類動物全細胞圖譜
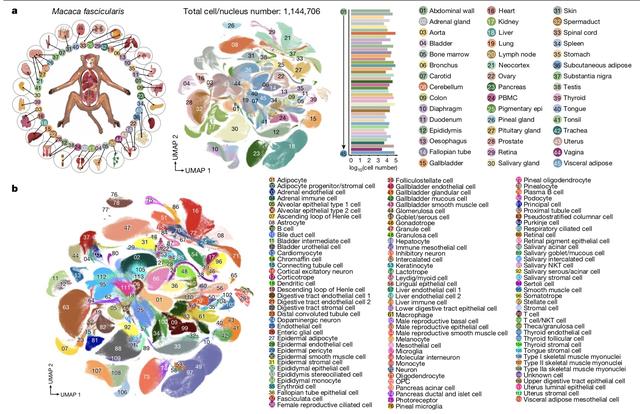
研究團隊最終基于華大自主研發的單細胞建庫和測序平台,對成年猕猴的45個器官的約114萬個細胞進行了單細胞測序分析。將其分成了113種主要的細胞類型和463種細胞亞類。
這也是全球首個非人靈長類動物全細胞圖譜。“實際上還可以繼續細分,就看研究人員希望得出多大的顆粒度,理論上可以分出上千上萬種,只要能理解細胞的功能是什麽。”劉龍奇認爲,細胞的精細分類是後續很多研究工作的基礎。
食蟹猕猴細胞圖譜。
目前這張猕猴圖譜爲我們提供了哪些信息?研究團隊選取了一些重要研究話題進行了初步的探索。其中包括,基于該圖譜,他們構建了包含新冠、乙肝、狂犬病毒等126種病毒易感細胞類型的病毒數據庫。這就像一本“病毒字典”,可以通過它快速查詢病毒最有可能侵染的細胞類型,同時看到該細胞類型可能分布的器官。
尤其值得關注的是,鑒于COVID-19大流行仍在全球蔓延,這項研究集中研究了新冠病毒(SARS-CoV-2)的受體ACE2(血管緊張素轉化酶2)和TMPRSS2(跨膜絲氨酸蛋白酶2)。此前的多項研究已經證明,SARS-CoV-2進入宿主細胞是通過刺突蛋白(S蛋白)與細胞表面的ACE2結合,以及TMPRSS2裂解S蛋白而啓動的。ACE2被比作爲病毒入侵的“門鎖”,TMPRSS2則被視作“潤滑油”。
這項研究評估了它們在猕猴組織中的表達。它們分析發現,TMPRSS2在猕猴的多個組織中廣泛表達,ACE2的表達相對受限。ACE2在膽囊(粘液細胞、內皮細胞、腺細胞和平滑肌細胞)、睾丸支持細胞、腎上皮細胞(主要是近端小管細胞)、肺(纖毛細胞、棒狀細胞,特別是肺泡2型細胞)和肝髒(肝細胞,尤其是膽管細胞)中表達最高。
此前有研究認爲,ACE2+TMPRSS2+雙陽性細胞對SARS-CoV-2感染的風險較高。研究團隊注意到,這些細胞在猕猴膽囊細胞中數量最多,這也與COVID-19患者發生急性膽囊炎的報道一致。而在肺和腎細胞中也觀察到相當多的共表達,在其他細胞類型如膀胱上皮細胞、胰管和胰島細胞中則觀察到較少的共表達。
接下來,研究團隊還對猴子和人類ACE2和TMPRSS2的表達進行了比較分析。結果顯示,在這兩個不同的物種中,肝髒的模式相似,而膽囊、腎髒和肺的模式更爲不同。
他們在討論環節就此分析,這項研究表明,猕猴和人類之間比較發現,ACE2和TMPRSS2在不同細胞類型中的表達分布並不相同。“這可能會影響SARS-CoV-2的發病機制研究,並可能解釋爲什麽羟氯喹等藥物盡管在體外猴細胞系中提供了有希望的結果,但在人類中卻無效。”
當然,這樣的例子也同樣提醒,人類和猕猴之間存在靶細胞易感性的差異,盡管在神經系統疾病等方面,猕猴相比小鼠是更優的模式動物,但仍需謹慎對待實驗結果。
研究還提到,除了ACE2和TMPRSS2,許多其他分子也參與了促進SARS-CoV-2與細胞表面的結合或COVID-19的發病機制。“它們在猕猴組織中的表達或共表達、其他關聯和病毒與宿主的相互作用,以及物種間的差異,都可以通過NHPCA網站進行研究。”
劉龍奇談到,新冠只是一個典型的例子,“我們構建了整個病毒易感的數據庫,大家可以根據這個數據庫得到乙肝病毒、狂犬病毒等對應的受體在什麽器官裏面存在,爲疾病的臨床診斷和治療指明方向。”
值得一提的是,這項研究在華大團隊的主導下,由來自6個國家35個研究團隊共同完成。“研究覆蓋了45個器官,每個器官都是非常複雜的,很難說有哪一個獨立的團隊會對每一個器官都非常熟悉,所以我們跟國際上很多非常頂尖的團隊合作,去進行聯合解讀。”劉龍奇舉例道,對腎這一器官,團隊和腎髒病領域著名專家、劍橋大學臨床醫學院院長Patrick Maxwell教授合作,“確保我們充分理解這個器官中獲得的信息。”
劉龍奇認爲,這種全球合作的方式,特別是通過大科學計劃組織的方式去進行聯合解讀,“這應該是未來細胞圖譜發展的重要策略。”
研究團隊同時創建了數據庫。“圖譜作爲基本的數據,我相信國際上會有很多人使用這個圖譜進行數據的挖掘,我們現在也收到了很多這方面的需求,現在的數據也都是公開的。”劉龍奇談到,“首先,數據的體量是非常大的,一般的科研用戶接觸你的數據的方式,可能就是依賴一個很明確的數據庫。”
此外,這一數據庫是交互式的。“不管懂不懂數據分析,你都可以通過鼠標點擊去探索,我們現在建的是一個非常全的數據庫,一方面涉及到整個數據的展示,另一方面用戶對于他感興趣的基因、疾病的表型等,都可以通過這個數據進行探索選擇。”劉龍奇表示。
劉龍奇同時表示,單細胞測序領域,仍在期待在成本、性能等方面具有“降維打擊”式效應的技術和工具出現。全球研究團隊更好的合作,以及人類細胞圖譜的實現,或許都在期待下一個質的飛躍。
責任編輯:李躍群
校對:丁曉