2020年,是個特殊的年份。在這個醫改新十年開啓的當口,重磅政策密集出台,大洗牌和大整合的新階段即將到來。4千多家制藥企業面臨生死大考,如何突出重圍?創新成爲必然的選擇之路。
目前,市面上比較常見的做創新藥研發的企業,主要有兩種方式。一種是漸進創新模式爲主,從仿制藥逐步轉型爲Me-too/Me-better産品,最後追求First-in-Class或者Best-in-Class,這 種一般存在在傳統藥企轉型創新研發的路徑當中,例如恒瑞醫藥。另一種則是跨越創新模式,從企業誕生初期,就是沖著同類最佳創新藥研發進行,引領者通常是科研背景出身,白手起家十年磨一劍,例如如今市面上衆多的未盈利生物科技類公司。
但是,最近剛上港股市場的雲頂新耀-B(1952.HK),選擇了第三條路進行創新。雲頂新耀的出生,來自于著名PE機構(私募股權投資機構)康橋資本孵化而來。而這一特殊成長背景,使得公司在短短三年的時光之中,發展成爲上百億港元市值的上市公司。參考此前康橋資本孵化的美股公司天境生物(IMAB.US),上市至今漲幅達到187.92%,此次雲頂新耀新上市至今最高漲幅已經達到43.27%以上,那麽它背後的獨特性在哪裏?從長遠來看是否有投資價值呢?
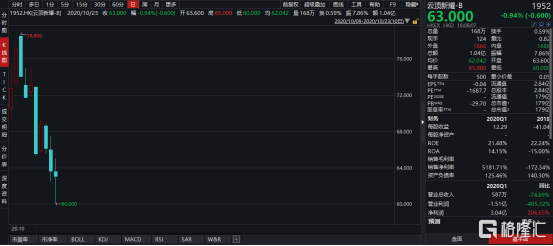
圖表一:雲頂新耀股價走勢圖
數據來源:WIND,格隆彙整理 數據截止2020年10月23日收盤
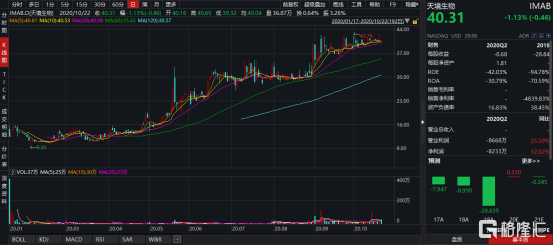
圖表二:天境生物股價走勢圖
數據來源:WIND,格隆彙整理 數據截止2020年10月23日收盤
雲頂新耀:三個重要的轉折
對于一個創新藥企新秀而言,上市不是終點,能夠爲患者帶來福音才是最終的目的,在追求當中,雲頂新耀也將面臨三個重大的轉折點。
雲頂新耀的CEO,Kerry Blanchard博士向格隆彙解釋到,雲頂新耀采取的是license-in(授權引入)的模式,引進的藥物將作爲未來最基礎的研發重點,從而幫助及鞏固壯大藥物組合。未來3-5年當中,公司將經曆三大變化:
第一個變化,就是商業化進程變化。從臨床開放階段進入到商業化階段,新藥會陸續地獲得國內的上市批准並且商業化上市,現在已經非常接近商業化上市的階段。
第二個變化,就是本土生産變化。目前在臨床試驗階段,公司8款藥中的7款臨床試驗用藥都是從國外進口,而不是在中國生産的,“但是我們計劃建立生産工廠,未來公司的這些引進藥物都會陸續在中國的工廠本土進行生産。”
最後一個變化,就是自主研發變化。這也是最重要的變化,就是雲頂新耀正在組建自己更大規模的研發團隊。Kerry Blanchard博士在行業以及在學術方面、醫學方面有30-40年的經驗,不管是在科學方面還是藥物研發方面,都是他的專長,隨著公司研發團隊的打造,未來這種自主研發的模式也會在計劃中。
獨特的商業模式:license-in
Kerry Blanchard博士提到的license-in模式,正是雲頂新耀獨特的商業模式。
License-in(授權引入)是一種産品引入方式,核心是“産品引進方”向“産品授權方”支付一定的首付款,並約定一定金額的裏程碑費用(按照品種開放進展)以及未來的銷售提成,從而獲得産品在某些國家(地區)的研發、生産和銷售的商業化權利。
相比起傳統的醫藥企業自己研發而言,license-in 首先能夠幫助公司快速豐富産品管線。以雲頂新耀爲例,過去的3年當中,公司主要考慮到如何快速的擴大規模,所以共計進入8個産品,並且以進入晚期臨床開發階段的産品爲主。License-in的方式幫助雲頂新耀完成了最開始從0到1的轉變,而伴隨著雲頂新耀上市後進入新的階段,在授權引入的産品類型與階段也會跟隨之前投入産品的方向進行深耕。
其次,license-in能夠快速進入市場。通過授權引入的方式,産品可以做到與國外先進産品幾乎同步的産品周期,這就意味著能夠第一時間進入市場,建立先發優勢。對于雲頂新耀而言,有些市場例如像台灣、韓國、新加坡不需要做額外的臨床試驗,利用美國等發達國家的臨床數據及獲批資料,就可以申請批准上市,從注冊角度來看,是非常有價值的。
雖然研發進程能夠加快,但並非看起來那麽容易,也不是每家企業都能夠做到license-in模式,資金是否雄厚,選産品的眼光,商業化的能力,缺一不可。
對于背靠康橋資本的雲頂新耀而言,購買力自然不是問題,難點其實在“選什麽”。對于醫藥行業而言,創新研發通常都是高風險和高投入的一個過程。按照公開資料顯示,藥物研發如果還沒有進入臨床階段,成功率只有不到10%,風險程度較高。對于追求全球首創或者全球最佳産品的雲頂新耀而言,更加傾向于擁有確定性高的臨床後期産品,這樣風險更加可控。
2019年4月,雲頂新耀與Immunomedics(IMM.US)訂立許可協議,以成交額8.35億美元的價格購買了sacituzumab govitecan在大中華區、韓國和某些東盟國家(不包括日本)等東南亞地區的獨家開發及商業化權益,成爲當時大中華地區最大一筆單一資産許可協議。
重磅引入的資産在今年4月開花結果。Sacituzumab govitecan成功獲得美國FDA批准,成爲全球首個治療轉移性三陰性乳腺癌的抗體藥物偶聯物(ADC),也成爲首個針對trop-2靶點的靶向藥物。核心産品sacituzumab govitecan的成功獲批,不僅證明著雲頂新耀在選品方面的獨具慧眼,同時也給了外界投資者一劑強心劑。
研發情況:布局4大領域,8款候選藥物
在看清楚公司的商業模式之後,我們再來看一下公司最核心的在研産品管線布局情況。
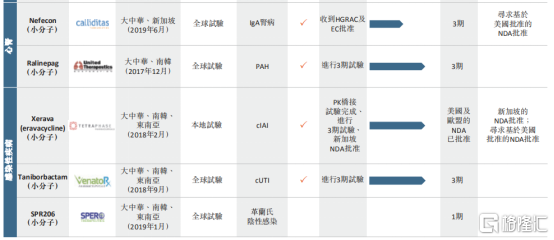
根據公司的招股說明書中披露,公司共計擁有8項候選藥物,涵蓋領域包括腫瘤、自身免疫性疾病、心腎以及感染性疾病,其中多項候選藥物已經接近商業化進程。
圖表三:公司在研産品管線
數據來源:公司公告,格隆彙整理
1. Sacituzumabgovitecan 腫瘤疾病支柱資産,First-in-Class, 中國獲批IND臨床(新藥臨床研究申請)
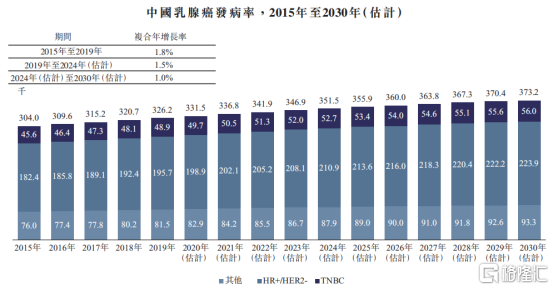
在中國,乳腺癌位居城市女性惡性腫瘤發病率之首,近年來發病率持續攀升。根據Frost&Sullivan數據統計顯示,2019年中國乳腺癌的新確診病例數32.62萬人,預計2030年將達到37.32萬人。
圖表四:中國乳腺癌發病情況
數據來源:Frost&Sullivan,格隆彙整理
根據Frost&Sullivan數據統計顯示,三陰性乳腺癌在所有乳腺癌中占比約15%,其惡性程度堪稱所有乳腺癌中最高。這是由于三陰性乳腺癌的三個重要基因:雌激素受體、孕激素受體、人表皮生長因子受體-2(HER2)表達均爲陰性,致使內分泌治療及抗HER2靶向治療的方案對之療效甚微。
如果是晚期三陰性乳腺癌患者,治療手段有限,容易産生耐藥性,而且患者的生存期較短,是臨床治療上的一個難題。因此,爲了突破這一“瓶頸”,醫藥研究者們將目光投向ADC藥物的研發。
抗體藥物偶聯物(ADC),就像是一個生物導彈,主要由兩部分核心功能組成:第一部分是(導彈體),第二部分是強化療藥(核彈頭)。這種設計會使抗體帶著化療藥去找腫瘤細胞,然後精准地毒殺腫瘤細胞。。這種藥物設計結合了靶向藥的精准和化療藥的高效,既避免了全身使用化療藥的毒副作用,也比單獨使用靶向藥具有更強的殺傷能力,一舉兩得。
2020年4月22日,Immunomedics公司宣布,美國FDA已加速批准其抗體藥物偶聯物Trodelvy(sacituzumab govitecan-hziy)上市,用于治療既往接受過至少2種療法的轉移性三陰性乳腺癌(mTNBC)成人患者,批准時間比預定的6月2日審批日期提前了一個半月。
Sacituzumab govitecan既是FDA批准的首個治療三陰乳腺癌的抗體藥物偶聯物,也是全球首個獲批的靶向人滋養層細胞表面抗原2(TROP-2)的抗體藥物偶聯物。
它由兩部分組成:靶向藥部分TROP-2抗體和化療藥部分SN-38(類似于伊立替康)。與其他的ADC藥物一樣,TROP2抗體部分可以特異地結合到腫瘤細胞表面,比如乳腺癌、腸癌和肺癌細胞;而SN-38可以輕松毒死癌細胞。
從作用機理來看,TROP-2在多種腫瘤細胞(如:乳腺癌、宮頸癌、結直腸癌、腎癌、肝癌、肺癌、胰腺癌、前列腺癌等)中均有過度表達。理論上,該藥對各種實體腫瘤均有治療潛力。事實上,除三陰性乳腺癌外,多項臨床試驗也在同步開展中。
2020年4月,雲頂新耀也在中國就sacituzumab govitecan爲治療轉移性三陰性乳腺癌(mTNBC)三線治療的臨床試驗取得國家藥監局的IND批准,預計在2020年及2021年展開轉移性三陰性乳腺癌(mTNBC)三線治療橋接注冊性試驗、HR+/HER2-mBC三線治療注冊性試驗、轉移性尿路上皮細胞癌2/3線注冊性試驗,以及亞洲籃子研究,當中包括具有高TROP-2表達的多種癌症類型的病患。
2. FGF401: 腫瘤疾病候選藥物,潛在新療法,臨床1/2期
FGF401是成纖維細胞生長因子受體4(FGF4)的小分子ATP競爭性抑制劑,有望成爲用于肝細胞癌(HCC)以及其他FGF19-FGFR4通路激活的實體瘤的潛在新療法,公司已獲得了全球範圍內的授權許可。
肝細胞癌,是最爲常見的肝癌形式,被俗稱爲“癌中之王”。根據Frost&Sullivan數據統計顯示,中國的肝細胞癌新發患者病例數已經從2015年的33.3萬例增長至2019年的36.9萬例,預計在2030年將達到47.3萬例。
目前,FGF401已經完成了單藥的首次人體臨床1期試驗,在中國處于臨床1/2期試驗階段。未來將主要針對中國市場,滿足中國肝癌患者的需求。
3. Eravacycline(Xerava): 感染性疾病核心候選藥物,Best-in-Class,美國及歐盟NDA批准
Eravacycline是一款抗生素藥物,對于多重耐藥性(MDR)及常見中國的革蘭氏陰性病原體(例如腸杆菌及鮑曼不動杆菌)有較強的抑制作用。
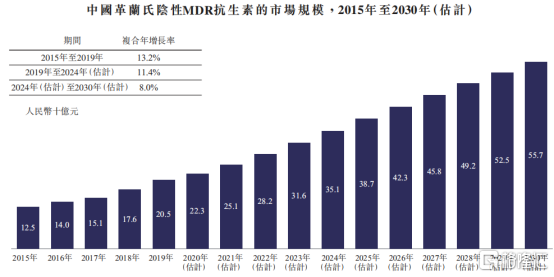
從行業增速上來看,中國新型抗生素市場強勁。根據Frost&Sullivan數據統計顯示,2015年至2019年中國抗感染藥物市場年複合增長率爲3.6%。其中,中國革蘭氏陰性MDR抗生素的市場增長更加迅速,2015年至2019年年複合增長率爲13.2%,2019年達到205億元人民幣市場規模,預計2030年將達到557億元人民幣。
雲頂新耀的eravacycline是由Tetraphase Pharmaceuticals許可,原授權公司的産品已于美國及歐盟獲批准用于治療複雜性腹腔內感染(cIAI),對由革蘭氏陽性及革蘭氏陰性病原體(包括耐藥菌株)而受感染的患者展現出高臨床治愈率。目前eravacycline産品于中國進行cIAI 的3 期注冊性試驗,用于支持中國的注冊申請。
圖表五:中國革蘭氏陰性MDR抗生素市場規模
數據來源:Frost&Sullivan,格隆彙整理
4.Etrasimod:免疫性疾病核心候選藥物,Best-in-Class,處于臨床3期試驗階段
Etrasimod是Arena Pharmaceuticals開發的新一代口服高度選擇性S1P受體調節劑,可選擇性靶向S1P受體亞型1、4及5來提供全身及局部細胞調節,同時避免與潛在嚴重不良事件(SAE)相關的亞型2和3,有望成爲同類最佳藥物(best-in-class)。
目前,Etrasimod正在全球開發潰瘍性結腸炎(UC)和特應性皮炎(AD)的研究。雲頂新耀于2017年達成合作協議,獲得這個産品在大中華區和韓國的獨家權益,並于2018年啓動了國內的臨床開發。當前産品正在國內開展3期UC的臨床研究。
UC屬于炎症性腸病(IBD)的一種,在我國發病率較低,不過近年來有逐年升高的趨勢。根據Frost&Sullivan數據統計顯示,2019年我國UC患病人數達到40.02萬人,伴隨著生活水平的提升以及高脂高蛋白飲食增長,預計2024年將達到58.67萬人,2030年將達到91.83萬人,年複合增長率分別爲7.9%以及7.8%。與其他自身免疫性疾病一樣,因藥價、自身觀念等原因,在國內這類患者未得到很好的醫療,目前中重症患者主要還是采用皮質類固醇進行系統治療。
5. Nefecon: 心腎疾病支柱資産,First-in-Class,處于臨床3期試驗階段
Nefecon是瑞典公司Calliditas Therapeutics研發的布地奈德口服制劑,屬于免疫抑制劑,正在開發用于自身免疫疾病IgA腎病(IgAN)。
IgAN是最常見的原發性腎小球腎炎,在亞洲人群中發病率明顯高于西方國家,根據中國南京金陵醫院數據統計顯示,2014年我國IgAN腎病發病率約占原發性腎小球腎炎的53%。根據雲頂新耀的招股書估計,2019年中國患病人數爲218萬。該病發展緩慢,但25-30%的患者會在20-25年後出現終末期腎病(ESRD),是導致ESRD的主要疾病之一。
截止目前,全球尚無專門針對IgAN的藥物獲得監管機構的批准。對于存在蛋白尿的患者,通常采用血管緊張素轉換酶抑制劑(ACEI)和血管緊張素2受體阻滯劑(ARB)控制血壓和減緩疾病進展。在使用免疫抑制劑治療該疾病上,目前存在爭議。國際臨床治療共識建議,對快速進展型的IgAN,可在血管緊張素抑制治療的基礎上聯用糖皮質激素進行治療。
Nefecon屬于糖皮質激素類藥物,采用新穎的口服緩釋劑型,使藥物在回腸,也就是IgA沉積的系膜區定點釋放,以避免全身用藥導致的毒性,增強布地奈德的生物利用度。
目前Nefecon正在開展臨床3期研究,有希望成爲全球首個獲批用于IgAN治療的藥物。雲頂新耀于2019年獲得這個藥物在中國的權益後,已經申報並獲得了臨床研究的許可,計劃在2020下半年加入全球3期臨床試驗。
小結
雲頂新耀從創立至今,可謂是生物藥企的“後浪”,發展之快直追藥企們“前浪”的步伐。
從獨特性上來看,公司選擇了license-in的道路,基于全球授權許可獲得後期階段的在研管線,成功率高,無需負擔前期研發投入。從當時重大的license-in事件到FDA獲批不到一年,拳頭産品Trodelvy喜訊背後,也將迎來公司盈利的曙光。根據雲頂新耀CFO Ian Woo介紹,公司在一些腫瘤産品的適應症銷售潛力非常大,有望超過十億規模。
從商業化能力上來看,公司的商業化進程已經臨近。根據雲頂新耀CEO Kerry Blanchard博士介紹,公司主打的8款産品,有2款藥物有希望在接下來2年內完成最終審批批准和上市,其他藥物獲批許可預計在2024年或者2025年獲得。