1、CXO 行業發展曆程
1.1 醫藥外包行業簡介
醫藥外包行業主要分三個環節。科技變革和全球化進展加深,藥企的研發活動愈發從獨 立自主研發向研發外包轉移,相應的 CRO 和 CMO/CDMO 行業在藥物研發深化影響下高速 發展,醫藥外包組織已經貫穿到藥品生命周期的全流程。CRO、CMO/CDMO、CSO 等名詞在 醫藥行業中愈發流行,其中 CRO、CMO、CSO 分別服務于醫藥行業的研發、生産、銷售三 大環節,可分別簡單理解爲研發外包、生産外包、銷售外包。
CRO 簡介。CRO(Contract Research Organization)是指合同研究組織,它是通過合同 形式爲制藥企業、醫療機構、中小醫藥醫療器械研發企業、甚至各種政府基金等機構在 基礎醫學和臨床醫學研發過程中提供專業化服務的一種學術性或商業性的科學機構。按 照工作的性質,CRO 大致分爲臨床前研究(Pre-Clinical)CRO 和臨床研究 CRO。臨床研 究 CRO 以接受委托臨床試驗(Clinical Trial)爲主。
CMO/CDMO 簡介。CMO(Contract Manufacture Organization)是指合同生産組織,主要是 接受制藥公司的委托,提供産品生産時所需要的工藝開發、配方開發、臨床試驗用藥、 化學或生物合成的原料藥生産、中間體制造、制劑生産(如粉劑、針劑)以及包裝等服 務。CDMO(Contract development and manufacturing organization)是指合同定制 生産組織,爲制藥企業以及生物技術公司提供定制化的研發生産服務,提供對醫藥特別 是創新藥工藝研發及制備、工藝優化、放大、生産、注冊和驗證、批生産以及商業化生 産等服務。二者比較,CDMO 在工藝設計及改進、分析測試、質量控制、申報文件准備、 成本控制等方面的經驗和技術將更勝一籌,更加有效的幫助新藥研發企業解決從實驗室 到新藥申報及商業化生産的各種問題。
CSO 簡介。CSO(Contract Sales Organization)是指合同銷售組織,其業務是根據與藥 品生産企業(或藥品銷售權所有人)簽訂藥品銷售合同取得銷售權,並基于藥品銷售獲得 報酬的一種銷售模式。
1.2 CRO 行業曆史
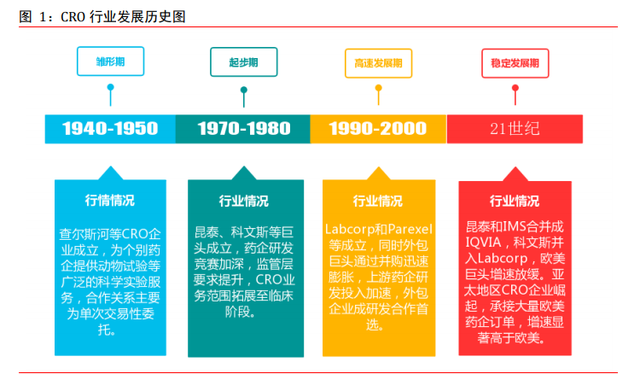
CRO 行業粗略分爲四個發展時期。從查爾斯河實驗室爲單一客戶提供交易性業務委托進 行的科學實驗服務開始,CRO 雛形初現。1970 年代 Dennis Gillings 教授創立昆泰開啓 了 CRO 巨頭時代,90 年代研發投入加速和並購活動盛行讓 CRO 行業迅速膨脹。進入 21 世紀後歐美巨頭增速放緩,亞太地區 CRO 企業崛起。可簡單把 CRO 行業發展分爲雛形期、 起步期、高速發展期、穩定發展期這四個時期。
雛形期。20世紀40至50年代,Huntingdon Life Sciences和Charles River Laboratories 等公司相繼成立,他們開始爲客戶提供動物實驗、藥物分析等廣泛的科學實驗服務。
起步期。當代意義的 CRO 行業出現于 20 世紀 70 年代至 80 年代,快速發展的藥企之間 開始了研發競賽,這對研發活動的成本和效率提出了更高的要求,同時監管層面對申報 規定和技術愈加複雜。CRO 行業在藥企研發競爭中相繼起步,這一時期誕生了昆泰和科文斯等外包巨頭,CRO 企業的業務類型從傳統的臨床前試驗擴展到臨床試驗、數據統計、 數據管理等其他服務。
高速發展期。20 世紀 90 年代,克林頓推行醫療改革令藥企銷售承壓,但市場上類似西 咪替丁和百憂解的成功並未令藥企放緩研發投入,爲了維持市場競爭力,藥企整體研發 投入依然有增無減,FDA 新藥通過數量在 90 年代後期快速增加。歐美 CRO 在高速發展期 通過並購整合加速發展步伐,如昆泰把業務拓展到亞太地區、查爾斯河收購 Inveresk、 PPD 收購 Pharmaco 等。
穩定發展期。進入 21 世紀,信息技術發展和全球化加深大大方便了藥企和外包企業之 間的國際合作。歐美巨頭發展多年體量倍增,同時上遊藥企研發投入增速放緩,大型 CRO 進入穩定發展期。與此同時,亞太地區 CRO 行業崛起,憑借相對低廉的人力成本和龐大 的患者群體,以中國和印度爲代表的發展中國家外包行業迅速發展,並承接了大量的歐 美藥企訂單。2000 年藥明康德成立,通過快速並購整合把業務拓展至外包全産業鏈;2004 年康龍化成成立,從實驗室化學開始業務逐步向臨床階段拓展;2004 年泰格醫藥成立, 專注于爲醫藥産品研發提供 I-IV 期臨床試驗等全方位服務。隨著中國醫藥行業進入創 新藥時代,研發投入增速顯著高于發達國家,國內 CRO 行業迎來了新的高速增長期。
1.3 從 Lonza 看 CMO/CDMO 發展曆程
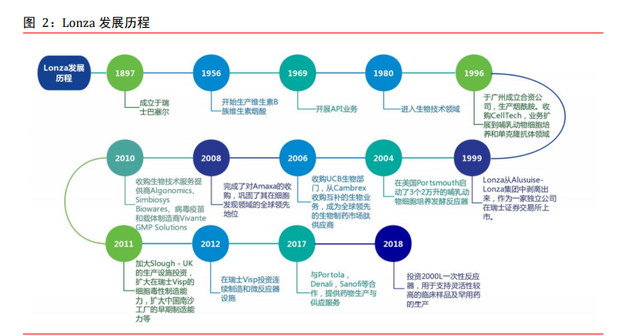
百年 Lonza 的並購整合之路折射 CDMO 行業發展史。1897 年,Lonza 于瑞士成立,通過 百年的發展,成爲了全球 CDMO 行業龍頭,2019 年營收 59.20 億瑞士法郎,折合約 426.41 億元人民幣。Lonza 主要生産生命科學産品以及多種類的精細和特殊化工産品,是活性 化學成分、中間體及生物技術解決方案的領先定制制造商,以高科技生命技術與優質産品聞名世界。1990 年以前,CDMO 行業大部分是大藥企利用自身過剩的産能來提供生産 服務,專業的 CDMO 企業稀少。Lonza 于 1969 年開展 API 業務從而切入 CDMO 行業。90 年代初,生物制藥市場仍在起步階段。Lonza 通過並購 CellTech Biologics,業務範圍 拓展到哺乳動物細胞培養和單克隆抗體領域。1999 年,Lonza 于瑞士證券交易所上市, 通過 IPO 獲得資金,加速産能擴張和企業並購活動。進入 21 世紀,Lonza 大量並購相關 企業,把業務範圍拓展至如多肽、蛋白質設計、基因治療等各個細分領域。同時,在 GMP 生産領域,繼續投資和擴大新型生物藥的制造能力,産能進一步擴張。近年來,全球新 藥研發投入持續上升,來自中小型或初創型公司的訂單逐漸增多,公司得到進一步發展。 從 Lonza 的發展曆程看,CDMO 企業往往從 API 入手,承接某一類特定産品訂單開始,隨 後進行企業並購、拓展業務範圍、投建産能等方式逐步擴大業務版圖。
2、外包行業概況
2.1 新藥研發各階段業務及代表企業
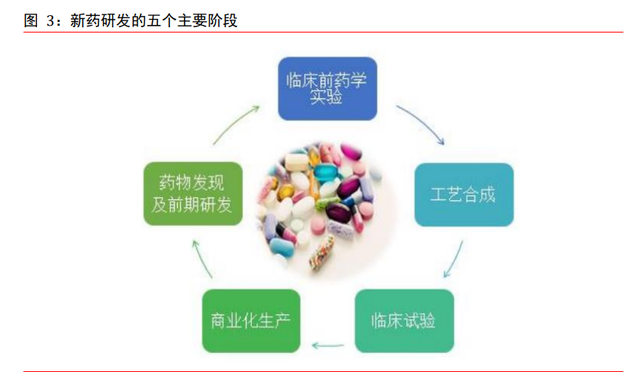
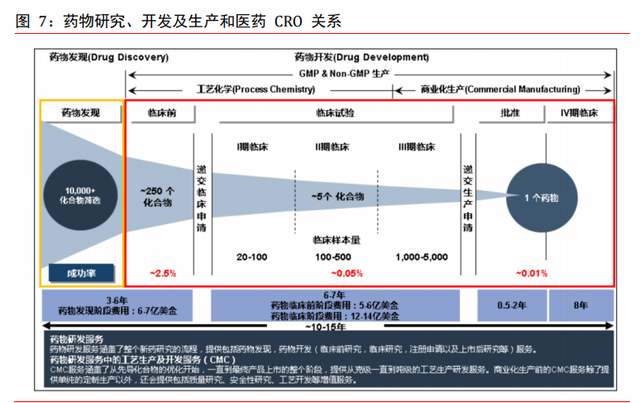
新藥研發分爲五個階段。新藥研發主要分爲藥物發現及前期研發、臨床前藥學實驗、工 藝合成、臨床試驗及商業化生産等五個主要階段。隨著全球新藥研發及銷售市場競爭的 日益激烈、新藥研發時間成本及支出不斷提高以及專利到期後仿制藥對原研藥利潤的實 質性沖擊,國內外大型制藥企業爲了縮短研發周期、控制成本、同時降低研發風險,逐 步將資源集中于發展自身核心研發業務,著重集中于疾病機理研究及新藥靶點的發現及 研發早期階段,而將後續研發中晚期及開發階段涉及的藥物化合物篩選及研發、數據采 集分析、臨床、委托生産或加工等産業鏈環節委托給醫藥研發服務企業,借助醫藥研發 服務企業資源在短時間內迅速組織起具有高度專業化和豐富經驗的臨床試驗團隊,更加有效地控制研發管理費用及協調內外部資源配置。
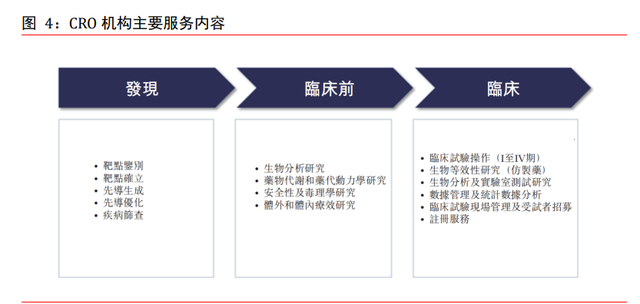
CRO 機構主要服務內容。在發現階段,CRO 機構主要提供靶點鑒別、先導化合物生成、 先導優化、疾病篩查等服務。在臨床前階段,CRO 機構主要提供生物分析研究、藥物代 謝和藥代動力學研究、安全性及毒理學研究、體外和體內療效研究等服務。在最重要的 臨床階段,CRO 機構主要提供 I 至 IV 期臨床試驗操作、針對仿制藥的生物等效性研究、 生物分析及實驗室數據分析、臨床試驗現場管理及患者招募、注冊等服務。
CDMO 機構主要服務內容。在臨床前階段,CDMO 企業主要提供安全性評價、藥物研究服 務、化合物篩選、毒理研究等服務。在臨床試驗階段,CDMO 企業主要提供工藝開發、試 驗小試、中試生産、配方設計等服務。在審批上市階段,CDMO 企業主要提供注冊申報、 上市後監測、IV 期試驗評估、持續研究等服務。在藥品生産階段,CDMO 企業主要提供工藝優化、質量控制、原料提供、組織生産等服務。
CRO 公司已滲透至研發各個細分領域。在長期的合作中,制藥企業逐漸與 CRO 公司建立 戰略性的合作關系,增強彼此商業合作的整合度,實現産業分工聯合競爭、協作競爭的 雙贏。對 CRO 企業來說,成爲制藥企業成熟的合作夥伴,彼此透明度更高,所面臨的 談判、評估更少,更多享受到制藥企業的資源,爲藥企提供更專業和個性化的服務。通 過建立長期合作,制藥企業可以基于不同的藥物開發需求選擇不同的 CRO 公司,借此 擴展數據資源,節約時間和成本。隨著市場需求的變化,制藥企業對 CRO 的要求也越 來越高,使得 CRO 滲透到研發的各個環節,貫穿從藥物發現、藥學研究、臨床前研究、 臨床研究到新藥注冊申報等,也由此在不同研發環節産生了若幹知名的國內外 CRO 企 業。
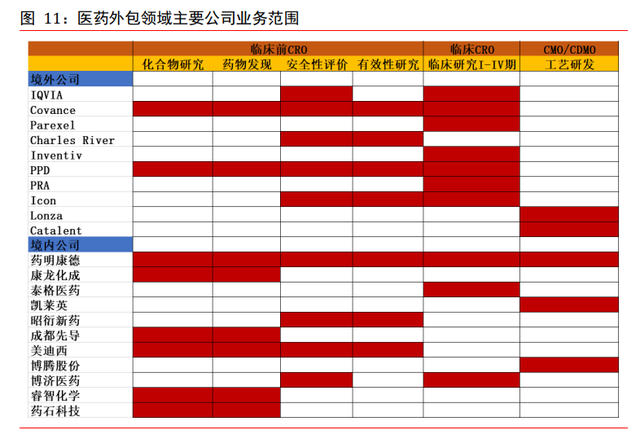
歐美 CRO 已成熟,中國 CRO 發展快。經過近五十年的發展,國外 CRO 行業已經逐步成熟, 培育出較大的市場規模,並形成了一套完整的業務流程體系,湧現了昆泰(IQVIA)、 科文斯(Covance)、PPD、查爾斯河實驗室(Charles Rivers Labs)、百瑞精鼎(Parexel) 等大型 CRO 公司,占據了國際 CRO 行業大部分的市場份額。中國 CRO 行業興起較晚, 但近年來發展勢頭強勁,隨著創新藥政策寬松、國際 CRO 需求轉移等宏觀環境變化而 快速增長,成立較早的藥明康德、睿智化學、泰格醫藥、博濟醫藥、美迪西等本土 CRO 公司已在國內市場具有較強的市場競爭力。在臨床前階段,藥明康德、康龍化成、昭衍 新藥、美迪西等主要臨床前 CRO 企業具備直接參與國際競爭的較強實力。
2.2 臨床階段是最大蛋糕
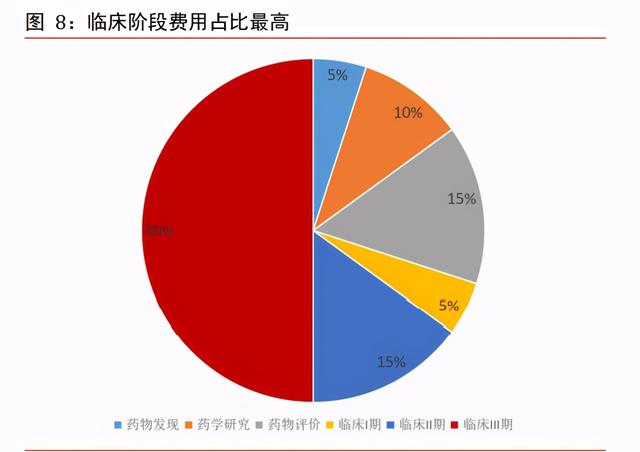
臨床階段研發耗時最長,費用占比最高。新藥研發是一個漫長的過程,總平均耗時 10 至 15 年。從時間角度看,臨床前階段耗時約 3 至 6 年,臨床階段耗時約 6 至 7 年,商 業化階段耗時約 0.5 至 2 年。從費用占比角度看,前期藥物發現階段費用約 6 至 7 億美 元,臨床前階段費用約 5 至 6 億美元,而臨床階段由于耗時長和人力成本高等原因,是 新藥研發中費用占比最高的階段,平均耗費 12 至 14 億美元。
臨床階段是研發過程最大蛋糕。臨床階段是新藥研發最重要的階段,業務主要有 I 到 IV 期臨床試驗、數據分析、臨床試驗研究、生物分析、CMC、生物等效性試驗、臨床現場 管理等業務。區別于臨床前的實驗室化學和動物試驗項目,臨床階段進行人體藥物試驗 需要更爲嚴格的監管,對試驗數據有更高的要求,平均 250 個化合物進行臨床試驗最後 僅 1 個能成功,從藥物發現開始至新藥上市的成功率約爲 0.01%。根據 Pharmapremia, 臨床 I 期品最終能夠成功獲批的比率是 11.3%,II 期 17.8%、III 期 53.4%、NDA 或 BLA 階段 89.1%。從階段費用占比看,臨床 I 至 III 期費用占比約 70%,是研發過程中最大 的蛋糕,同樣是 CRO 行業中天花板最高階段,其中 I 期占比約 5%、II 期占比約 15%、III 期占比約 50%。
2.3 醫藥外包市場格局
美國是 CRO 行業主要市場。藥物研發外包服務行業是一個全球競爭的行業,其最終用戶 包括制藥企業、生物科技研發公司以及科研院所等。下遊客戶涉及新藥研發領域的範圍 廣泛,對于新藥研發服務需求也存在較大的差異性。在全球範圍內可以提供藥物研發 CRO 服務的企業數目衆多,但是大多數企業業務集中于藥物研發的某一階段。全球從事藥物 研發外包服務公司衆多,市場較爲分散。根據前瞻經濟學人,從國別分布來看,美國爲 CRO 産業的先驅,也擁有最多的上市公司,CRO 市場比重約 55%;歐洲是比重次高的區域, 市場占有率約 30%,亞洲的比重則僅占 13%左右。
中國成爲 CRO 行業發展的熱點區域。歐美 CRO 市場在 20 世紀 90 年代已較爲成熟, 21 世紀隨著 CRO 巨頭的全球擴張和亞洲地區經濟科技的崛起,CRO 産業逐漸向亞洲轉 移。由于擁有世界上最大的人口基數,中國和印度擁有龐大的患者群體,臨床試驗樣本 數充足;印度擁有與歐美較爲相似的人種和病譜,相同的語言習慣;中國在臨床前和臨 床試驗各階段的研究試驗費用僅爲發達國家的 30%-60%,具有成本優勢;中國、韓國、 新加坡、印度等正經曆醫藥産業的迅速崛起,研發支出增長迅速。中國在成本和産業前景等方面的比較優勢使中國成爲 CRO 行業發展的熱點區域。
CMO/CDMO 市場逐步向亞洲轉移。目前全球 CMO/CDMO 市場仍主要集中在歐、美及日本等 發達國家市場。但由于上述市場勞動力及環保成本日趨昂貴,疊加以中國爲代表的亞洲 藥品市場需求爆發,以及在藥品專利保護制度建設上逐步完善,中國和印度等發展中國 家在固有的成本效益優勢的基礎上,隨著科研和制造實力的提升,全球 CMO/CDMO 市場 已陸續開始從西方成熟市場向亞洲等新興市場轉移。
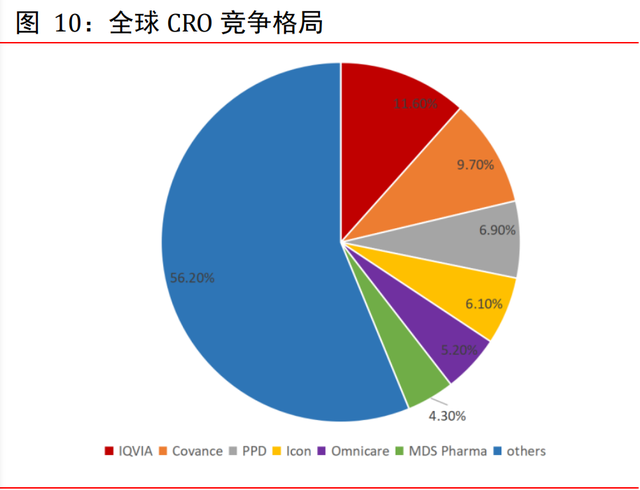
本土企業正縮小與國際巨頭的差距。從企業占比來看,IQVIA 是全球最大 CRO 公司,業 務涉及臨床前後兩階段,占有 11.6%的市場份額;Covance 業務同樣涉及 CRO 全流程; PPD 則專注臨床階段業務。其中昆泰、科文斯、PPD 等排行前列的 CRO 公司均已進入中 國。據統計,全球排名前十位的 CRO 擁有超過 50%的市場份額。國內的頭部 CRO 公司已 逐步拓寬業務線範圍,快速搶占中國醫藥市場快速增長的蛋糕,在專精業務階段已有相 當的競爭優勢和成本優勢。相較于跨國 CRO 企業,本土 CRO 企業熟悉國內市場,可提 供大部分臨床前或臨床試驗研究服務,大型本土 CRO 也紛紛吸引高端人才,展開跨國 並購,拓展國際業務規模,逐漸縮小與國際巨頭的差距。
境外外包公司概況。全球銷售額排名靠前的外包服務公司主要有 IQVIA(原昆泰)、 Covance(科文斯)、Parexel(精鼎)、InVentiv Health(因文健康)、Icon(愛科 恩)、PPD(醫藥産品開發公司)、PRA(制藥研究聯合公司)、Charles River(查爾 斯河實驗室)等。IQVIA(昆泰)是世界上最大的 CRO 組織,作爲良好臨床實踐(GCP) 的供應者,IQVIA(昆泰)實現了臨床試驗數量和質量的“雙重領先”。Parexel(精鼎) 是一家致力于藥物臨床試驗研究的 CRO 集團公司。Covance(科文斯)主要爲藥物和診 斷研發與商業化提供綜合臨床實驗室服務與點對點解決方案,業務覆蓋臨床前後階段。 Charles River(查爾斯河實驗室)是安全性評價龍頭公司。Lonza 和 Catalent 則專注 CMO/CDMO 階段的工藝研發服務。
本土外包公司概況。國內知名外包公司有藥明康德、康龍化成、泰格醫藥、凱萊英、昭 衍新藥、美迪西、博騰股份、博濟醫藥等。其中康龍化成和藥明康德具備大規模的實驗 室化學服務能力,業務發展模式由藥物發現階段延伸至藥物開發階段;泰格醫藥和博濟 醫藥業務專注于臨床期藥物開發服務;凱萊英和博騰股份業務專注于藥物開發階段的工藝研發及生産業務。
3、上遊研發投入加速,中國外包行業預期高增長
3.1 中國醫藥市場規模增速高于發達地區
3.1.1 全球制藥市場維持慢增長
全球制藥市場保持約 5%的年均增速,生物制劑增長更快。全球制藥市場 2018 年的規模 按收益預計爲 12,674 億美元,預計 2023 年將增至 15,953 億美元,該期間的複合年增 長率爲 4.7%。總體而言,全球制藥市場可以分爲兩個分部:化學藥物市場及生物制劑市 場。近五年生物制劑的增長速度超過化學藥物的增速。生物制劑市場于 2018 年至 2023 年預計按複合年增長率 9.0%增長,並于 2023 年達至 4,021 億美元,增長速度超過整體 制藥市場。生物制劑市場主要受生物制劑能有效解決針對于某些疾病尚無可用有效化學 藥物治療的情況推動。
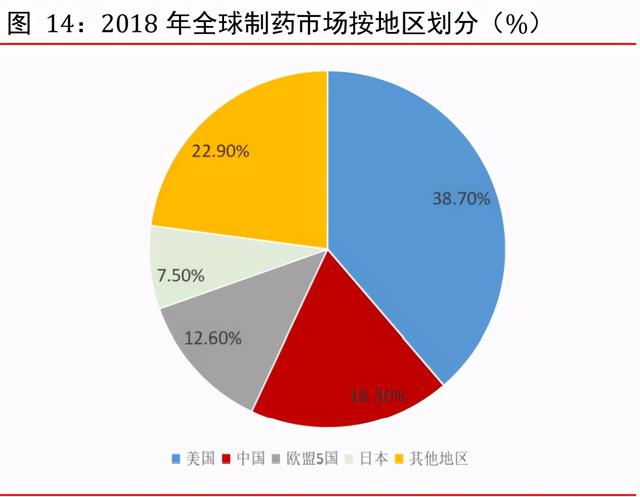
美國及中國爲全球最大的兩個制藥市場。2018 年美國和中國市場規模分別占全球市場的 38.7%及 18.3%。根據弗若斯特沙利文的資料,2018 年全球二十大制藥公司(按收益計) 爲 Pfizer(輝瑞)、Roche(羅氏)、Novartis(諾華)、Johnson & Johnson(強生)、 Merck(默克)、Sanofi(賽諾菲)、Abbvie(艾伯維)、GSK(葛蘭素史克)、Amgen (安進)、Gilead(吉利德)、BMS(百時美施貴寶)、Eli Lilly(禮來)、AstraZeneca (阿斯利康)、Bayer(拜耳)、Teva(梯瓦)、Novo Nordisk(諾和諾德)、Allergan (艾爾建)、Takeda(武田)、Celgene(新基)及 Shire(希爾)。
3.1.2 美國制藥市場增速放緩,創新藥仍是主流
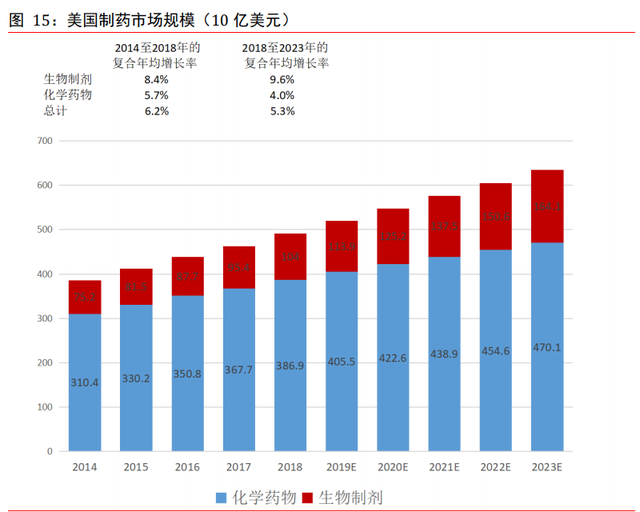
美國制藥市場維持約 5%的規模增速。2018 年,美國制藥市場規模爲 4,908 億美元,占 全球制藥市場的 38.7%,其市場份額超過中國(全球第二大制藥市場)逾 20%。美國制 藥市場的規模由 2014 年的 3,855 億美元增至 2018 年的 4,908 億美元,預計到 2023 年 將增至 6,342 億美元,2018 年至 2023 年期間的複合年增長率爲 5.3%。美國市場的增長 主要是由于公共機構及私人在醫療方面的支出以及出現更爲有效的治療疾病的新方法 而增加。與全球市場一致,美國的一個主要趨勢是,與化學藥物市場相比,生物制劑市 場的增速預期更快。美國生物制劑 2018 年的市場規模爲 1,040 億美元,預計 2023 年將 增至 1,641 億美元,預計 2018 年至 2023 年的複合年增長率預計爲 9.6%,而同期化學藥 物的複合年增長率爲 4.0%。預期美國制藥市場仍將重點關注專利藥。2018 年美國專利 藥的市場規模爲 3,797 億美元,預計到 2023 年將增至 5,025 億美元,占 2023 年美國制 藥市場總量的 79.2%。國內重點 CRO 和 CDMO 企業均有相當大比例的訂單來自美國市場, 特別針對專利藥研發,美國專利藥市場的快速增長有望爲國內研發外包企業帶來更多訂 單。
3.1.3 中國制藥市場增速高,生物制劑和創新藥有望延續高增長
中國制藥市場維持約 7%的規模增速。中國制藥市場規模由 2014 年的 1,822 億美元增至 2018 年的 2,316 億美元,預計 2023 年將增至 3,221 億美元,該期間的複合年增長率爲 6.8%。增長主要受人口老齡化及慢性病患病率相應上升以及中國政府的優惠政策推動, 該類優惠政策旨在開發中國高質創新藥物及生物制劑市場,增加可支配收入及擴大承保 範圍。
專利藥增速超越傳統仿制藥,中國醫藥市場向創新藥模式轉變。從曆史上看,仿制藥在 中國制藥市場的占比較之于仿制藥在全球市場的占比大。2018 年,中國仿制藥市場規模 達 1,030 億美元,占中國制藥市場總量的 44.5%,而仿制藥占全球制藥市場的 33.0%。 預計到 2023 年,中國仿制藥市場將增至 1,377 億美元,2018 年至 2023 年的複合年增長 率爲 6.0%。自 2018 年至 2023 年的未來五年內,預期中國政策將繼續著力鼓勵開發創新 專利藥,專利藥的投資預期將增加,其市場規模于同期預計按 7.5%的複合年增長率增至 2023 年的 1,844 億美元。
3.2 中國藥品研發支出預計維持 20%以上增長率
3.2.1 全球醫藥市場規模持續增長,帶動研發支出穩步上升
全球處方藥銷售額持續上升。伴隨世界經濟的快速發展、科技的不斷進步,以及人口老 齡化程度的加快,預計在醫藥開支方面,到 2020 年全球醫藥支出將達到 1.4 萬億美元, 比 2015 年增長 29-32%。處方藥是醫藥支出的主要部分,根據 EvaluatePharma 基于行 業領先的 500 家制藥和生物技術公司預測,全球處方藥銷售額將以每年 4.1%的速度增 長,到 2024 年預計將達到 12,040 億美元。
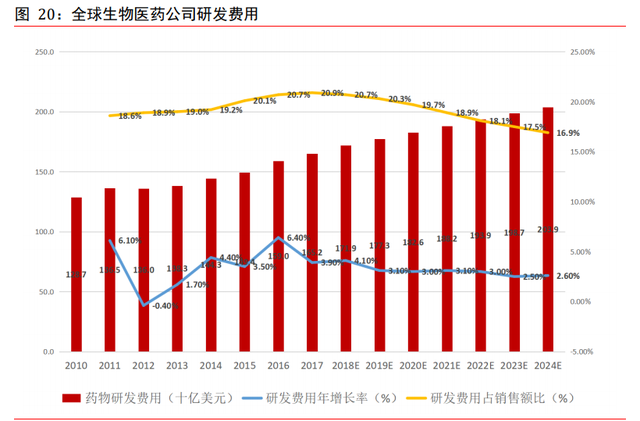
全球生物制藥公司研發費用維持上升趨勢。受益于醫藥行業剛需屬性、人口老齡化不斷 加劇、患者醫藥需求日益增加,全球醫藥市場未來仍將保持穩定增速增長態勢,爲醫藥 企業研發新藥提供了良好的外部環境。根據 EvaluatePharma 數據,全球醫藥研發費用 將從 2017 年的 1,651 億美元增長到 2024 年的 2,039 億美元,複合增長率爲 3.1%。
3.2.2 中國研發投入維持高增速
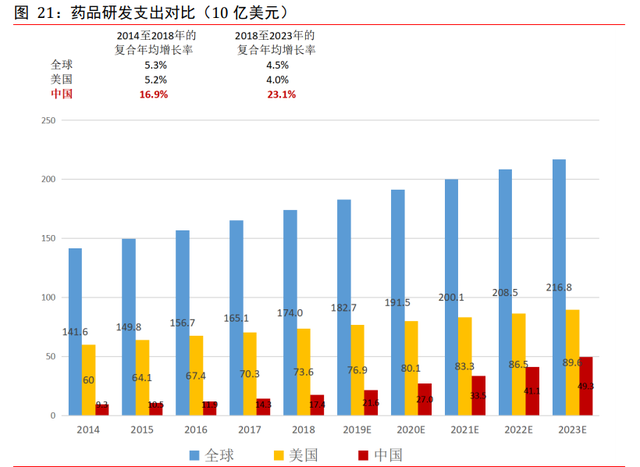
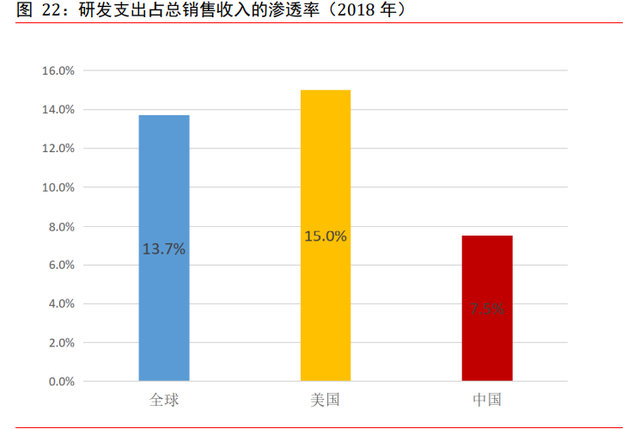
全球藥物研發支出增速約 4.5%。2018 年,全球制藥行業的研發支出總額爲 1,740 億美 元,預計 2018 年至 2023 年期間的複合年增長率爲 4.5%,2023 年將達至 2,168 億美元。 2018 年的研發支出占全球制藥市場總收入的 13.7%。
美國制藥公司的研發支出爲全球最高,但增速放緩。2018 年,美國藥品研發支出總額爲 736 億美元,占全球藥品研發支出 40%以上。2018 年,研發支出亦占美國藥品總銷售收 入的 15.0%,高于全球 13.7%的比例。到 2023 年,美國藥品研發支出預計將增至 896 億 美元,複合年增長率爲 4.0%。美國研發支出增加的主要原因是發現新療法過程中所出現 的挑戰,包括發現創新專利藥的複雜度日益提高。
中國藥品研發支出預計維持 20%以上增長率。于 2018 年,中國制藥研發總支出爲 174 億美元,預計到 2023 年將增至 493 億美元,2018 年至 2023 年的複合年增長率爲 23.1%, 相當于全球預計複合年增長率 4.5%的 5 倍以上。這一趨勢很大程度上是由于中國政府日 趨重視創新政策,包括鼓勵藥物創新及加強現有監管要求的政策,以及提升中國制藥公 司研發能力及資本流入。中國制藥公司的研發支出並不限于中國。越來越多總部位于中 國的制藥公司亦花費大量研發經費支持其他司法權區的申請,特別是在美國申請研究性 新藥及簡略新藥。此外,隨著近期監管及政策變化激勵進口藥品,中國的外企數量增加, 特別是來自美國的外企,該等公司正開展研發活動,以期將專利藥引入中國市場。
中國藥企研發支出滲透率仍有很大提升空間。于 2018 年,全球藥企平均研發支出占總 銷售收入占比約爲 13.7%,美國成熟的醫藥市場研發支出占比達 15%。對比之下,中國 同期研發支出滲透率僅爲 7.5%,滲透率未來有望隨創新藥推進持續而提升。
3.3 中國 CRO 市場增速約 28%,滲透率有望快速提升
3.3.1 全球 CRO 市場規模穩步提升
藥品外包企業爲制藥公司提供有利條件。制藥行業外包服務提供商將專業人才和專業知 識、先進的設備和方法、定制化的開發能力和産能以及質量、成本和風險控制系統結合 起來。提供的服務可幫助制藥公司加速項目時間表、控制風險、優化資源及降低成本。 根據弗若斯特沙利文的資料,制藥公司更趨向使用外包服務而非使用其自身內部的能力 的四大原因有:①節省成本:外包一般降低了藥物開發有關的整體研發成本。②開發專 業知識:外包有助于制藥公司獲取制藥公司研發部門內部未發現的能力。外包亦有助于 制藥公司繼續專注于其核心業務。③定制開發及執行效率:若幹服務的外包有助于藥物 開發過程中的執行效率及在最重大藥物開發挑戰中向制藥公司提供定制及科學研究、分 析及開發服務。④降低風險:外包予可靠及聲譽良好的合夥人降低了藥物開發過程中有 關的整體風險。
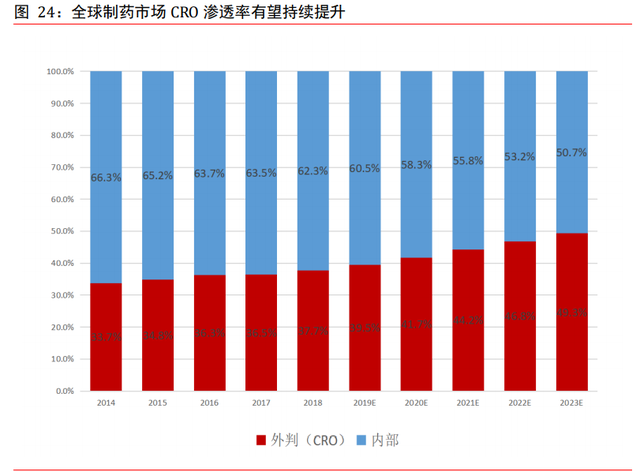
全球 CRO 維持約 10%年均增速,至 2023 年行業滲透率有望接近一半。根據弗若斯特沙利 文,全球制藥合同研究機構市場規模由 2014 年的 382 億美元增至 2018 年的 552 億美元, 預計 2023 年將增至 914 億美元,預計 2018 年至 2023 年期間的複合年增長率爲 10.6% 。 外包服務支出占外包及內部服務總支出的比例或市場外包服務對全球研發支出總額的 滲透率由 2014 年的 33.7%持續增長至 2018 年的 37.7%,預計 2023 年將增至 49.3%。
3.3.2 美國 CRO 市場維持約 9%年均增速
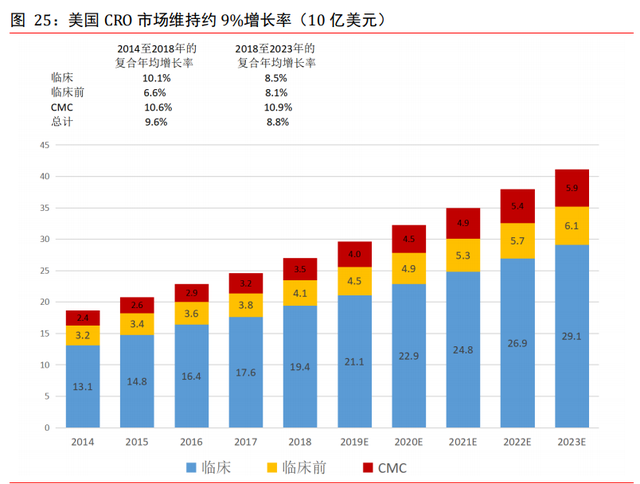
美國 CRO 市場維持約 9%年均增速,至 2023 年行業滲透率有望達 54%。根據弗若斯特沙 利文,美國藥品合同研究機構市場的規模由 2014 年的 187 億美元增至 2018 年的 270 億 美元,預計到 2023 年將增至 411 億美元,預計 2018 年至 2023 年期間的複合年增長率爲 8.8%。合同研究機構外包服務對美國研發支出總額的滲透率由 2014 年的 38.9%持續 增長至 2018 年的 43.2%,預計 2023 年將增至 54.1%,高于同期全球 49.3%的滲透率。
美國藥品 CRO 市場受美國制藥市場的增長推動。這包括尋求在競爭激烈及資源密集型行 業實現成本效益的大型跨國制藥公司以及初創和小型制藥公司,其中包括需要整套發 現、臨床前及臨床服務的虛擬公司。隨著研發支出的增加及對專利藥的關注以及近期生 物制劑的增長,美國合同研究機構市場同樣專注于爲高質素科學家提供適當技術知識以 及優質設施和設備以支持該等類型的項目。大型制藥公司通常尋求降低總體成本,包括 透過使用合同研究機構服務以及初創和小型制藥公司對綜合服務的需求,這意味著美國 制藥公司對合同研究機構的運用將繼續增長。
3.3.3 中國 CRO 市場年均增速接近 30%
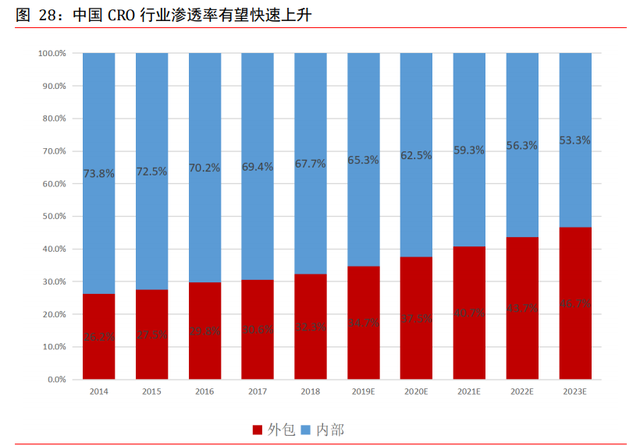
中國臨床 CRO 維持約 30%以上增速,臨床前 CRO 維持約 20%增速。根據弗若斯特沙利文, 中國藥品合同研究機構市場的規模由 2014 年的 21 億美元增至 2018 年的 55 億美元,預 計到 2023 年將增至 191 億美元,預計 2018 年至 2023 年期間的複合年增長率爲 28.3%。 外包服務對中國研發總支出的滲透率由 2014 年的 26.2%持續增長至 2018 年的 32.3%, 預計 2023 年將增至 46.7%,低于同期全球滲透率 49.3%,但增長速度較快。臨床 CRO 景 氣度最高,未來有望維持 30%以上的增速,而臨床前 CRO 和 CMC 則有望維持 20%以上的 增速。
中國制藥市場增長令中國 CRO 市場受益。中國藥品 CRO 市場在過去取得顯著增長,其中 很大一部分市場專注于仿制藥的開發。隨著近期推出的激勵創新的鼓勵性政策,預計專 利藥的開發將占據更多的市場份額。新外國藥物贊助商及跨國制藥公司進駐中國或會加 強對專利藥開發的重視。
一致性評價持續推進增加 CRO 行業需求。于 2016 年 3 月頒發的《國務院辦公廳關于開 展仿制藥質量和療效一致性評價的意見》,一致性評價意見旨在淘汰未完成質量和療效 一致性評價的仿制藥,以提升中國仿制藥的整體質量和競爭力。一致性評價意見要求制 藥公司就已經上市或正在開發的仿制藥開展生物等效性研究,中國對優質合同研究機構 服務的需求有所增加,尤其是生物等效性服務。該政策強化了監管標准,導致對高質素 生物等效性及生物分析合同研究機構服務的需求顯著增加,原因是過往缺乏現有的生物 等效性數據及在內部進行生物等效性研究的能力。一致性評價意見的長期影響是標准提 高令參與在中國經營仿制藥開發的制藥公司數目可能增加及制藥公司研發開支水平增 加,其可能導致有關公司未來的外包水平進一步增加。
多項政策鼓勵藥品創新,令合同研究機構服務的需求有所增加。例如,《關于深化審評 審批制度改革鼓勵藥品醫療器械創新的意見》建議了多項措施,包括改革臨床試驗管理 及加快審批流程,以推廣創新藥品。由于中國成爲人用藥品技術要求國際協調理事會的 第八個成員國,對臨床試驗欺詐采取零容忍立場,故爲了確保高質量的臨床試驗,市場 對可靠的合同研究機構需求殷切。另外,另一個增長動力爲中國政府對藥物創新的直接 支持,因而對合同研究機構服務的需求增加。該等政策包括《醫藥工業「十二五」發展 規劃》;及《關于組織實施生物醫藥合同研發和生産服務平台建設專項的通知》。此外, 中國制藥公司將業務擴展至其他地區市場(尤其是美國),以及近期有關進口藥品進入中國市場的鼓勵政策預期將進一步提升對具有中國監管程序經驗及國際標准的高質素 合同研究機構的需求。
3.4 臨床階段 CRO 景氣度最高
3.4.1 中國市場的臨床階段 CRO 有望維持 30%增速
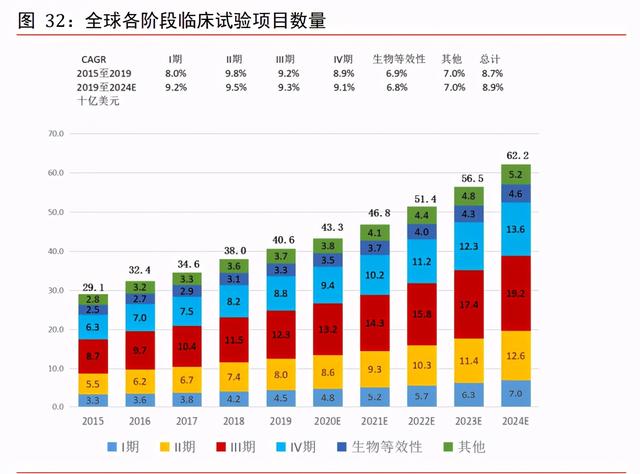
臨床階段 CRO 未來仍然占據主要份額。制藥公司倚賴精通項目管理及科學專門知識、具 備專業及經驗豐富人才、創新科技與豐富監管經驗的合同研究機構管理複雜項目,以減 低研發風險與成本及加快開發安全有效的藥物。根據弗若斯特沙利文,預測從 2019 年 至 2024 年,發現、臨床前、臨床這三個主要階段的 CRO 市場規模整體維持 8.9%的複合 增速。預測至 2024 年,三個階段合計市場規模約 960 億美元,其中臨床階段 CRO 約 622 億美元,占比約 64.79%,將仍然是外包市場最重要的部分。
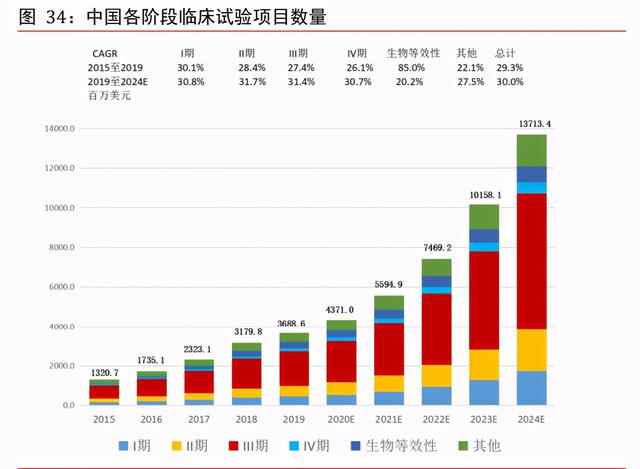
中國市場裏臨床階段 CRO 有望維持 30%增速。爲促進醫藥創新,中國已采取監管審批制 度的改革,覆蓋中國制藥市場從臨床試驗、提交監管文件、生産至醫療保險保障範圍的 整條價值鏈。改革已爲專門從事創新藥物研發的合同研究機構提供更多商機。新興生物 科技公司爲數衆多(尤其在中國),而由于內部資源及能力有限,大部份該等新興生物 科技公司廣泛依賴第三方服務提供商指導其複雜的研發項目,因而産生對合同研究機構 服務的額外需求。受益于上遊醫藥研發投入的快速增加、中國創新藥政策推動、中國人 才和成本優勢等因素,中國 CRO 市場增速將長期維持高增長,並遠超歐美發達地區。根 據弗若斯特沙利文,預測中國地區從 2019 年至 2024 年,發現、臨床前、臨床三個階段 CRO 市場規模分別維持 26.0%、18.2%、30.0%的複合增速,整體增速爲 26.5%。與全球市 場類似,中國地區臨床階段 CRO 是最重要的部分,未來有望維持 30%的複合增速,至 2024 年規模有望達到 137 億元,占比約 61.71%。
3.4.2 全球臨床試驗項目數量持續增加
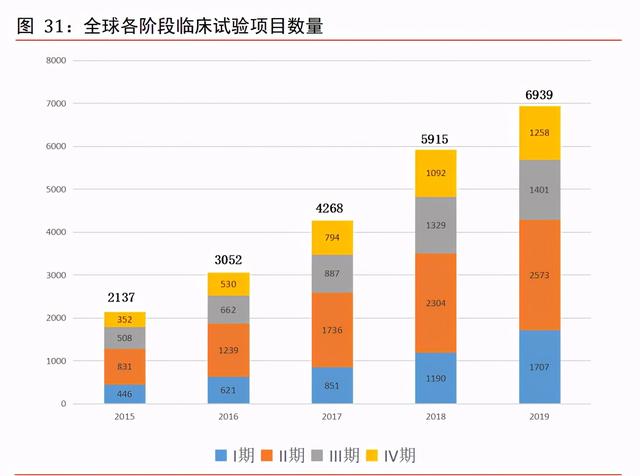
全球臨床試驗項目數量持續增加。臨床合同研究機構市場主要包括①臨床試驗操作、② 數據管理及統計數據分析以及③現場管理與患者招募服務。根據弗若斯特沙利文,全球 臨床試驗數量持續由 2015 年的 2,137 項增至 2019 年的 6,939 項,全球臨床合同研究機 構市場的規模由 2015 年約 290 億美元增至 2019 年的 406 億美元,預計于 2024 年將增 至 622 億美元,2019 年至 2024 年的複合年增長率爲 8.9%。拆分環節看,預測從 2019 年至 2024 年的各階段複合增速,I 期 9.2%、II 期 9.5%、III 期 9.3%、IV 期 9.1%、生 物等效性 6.8%、其他 7.0%,整體增速爲 8.9%,其中 II 期略微偏高。從費用分布看,預 測 2024 年臨床 CRO 市場達 622 億美元,I 期、II 期、III 期分別占 70、126、192、136 億美元,而生物等效性占 46 億美元,III 期是費用占比最高的環節。
3.4.3 中國臨床試驗項目數量增速高
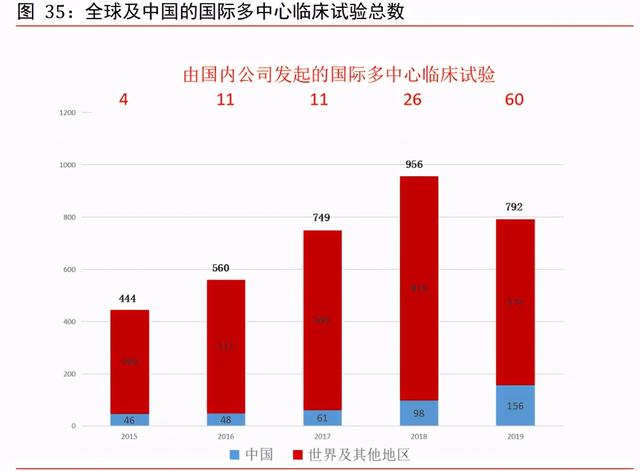
中國臨床試驗項目數量快速增長。中國的臨床試驗數量由 2015 年的 339 項增至 2019 年 的 1,031 項,CAGR 約爲 32.06%。由于藥品研發繼續全球化及中國成爲全球藥品研發行 業不可或缺的市場,在中國進行的國際多中心臨床試驗數量亦有所增加。中國自 2017 年加入 ICH 後,一直更新其監管藥品臨床開發的規例以符合發達市場的有關規例。ICH 爲旨在統一各國有關藥品開發及注冊的技術及監管規定的組織。具體而言,海外所得臨 床數據可應用爲補充數據,以支持在中國進行注冊申請。另一方面,跨國制藥公司在中 國的臨床試驗中心進行國際多中心臨床試驗呈增長趨勢,以支持其向國家藥監局的注冊 申請。
中國吸引愈來愈多的全球生物制藥公司在中國進行國際多中心臨床試驗。在中國進行國 際多中心臨床試驗目的:①善用本地及全球所得臨床數據加快臨床開發流程;②觸及中 國大型的患者群;及③享有中國較低的成本基礎。愈來愈多的國內公司亦提倡在中國進 行國際多中心臨床試驗,借以將其候選藥物進行全球商業化。中國的國際多中心臨床試 驗數量因而由 2015 年的 46 項(占全球國際多中心臨床試驗總數的 10.4%及中國所進行 臨床試驗總數的 13.6%)大幅增至 2019 年的 156 項(占全球國際多中心臨床試驗總數的 19.7%及中國所進行臨床試驗總數的 15.1%)。此外,中國公司發起的國際多中心臨床試 驗數量由 2015 年的 4 項大幅增至 2019 年的 60 項。
3.4.4 臨床細分領域預期維持良好增長趨勢
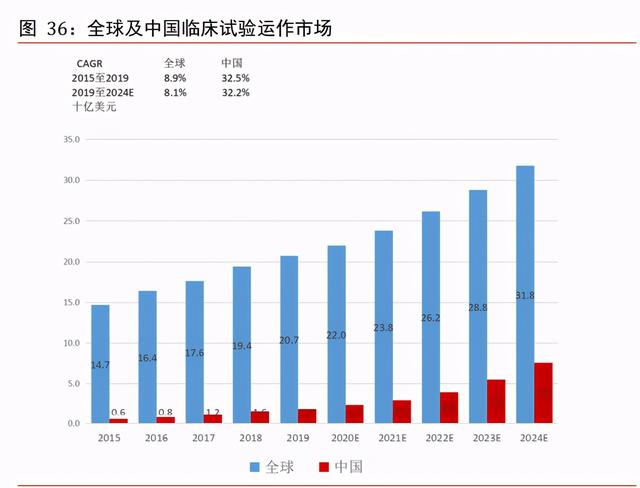
臨床試驗運作被視爲臨床合同研究機構服務的骨幹部份。臨床試驗運作主要包括臨床計 劃與協議設計、選址與場地啓用、項目管理、臨床試驗監察、醫療著作與翻譯及監管事 務,該等服務通常于當地進行。于 2019 年,臨床試驗運作爲臨床合同研究機構市場的 最大分部,占全球臨床試驗合同研究機構市場 51.0%。
數據管理及統計數據分析。數據管理及統計數據分析一般包括①數據管理服務,主要包 括臨床數據采集、臨床數據庫設計、臨床數據輸入與儲存、醫療程序編寫及臨床數據核 查、輸出、傳輸及存檔;及②統計數據分析服務,主要包括制定統計數據分析計劃、進 行實際統計數據分析及編撰統計數據分析報告。
數據管理及統計數據分析市場的增長主要受臨床試驗日趨複雜和新興數據生態系統及 數碼轉型帶動。① 臨床試驗日趨複雜;日趨複雜的臨床試驗設計及于臨床開發過程中 應用各種先進技術,刺激對大規模進行先進數據管理及統計數據分析的需求上升。大型 國際多中心臨床試驗要求可擴大的數據管理基礎設施,而療效指標設計新穎的臨床試驗 則需要更多先進統計工具。②新興數據生態系統及數碼轉型;領先的臨床合同研究機構 持續投資于雲基礎數據生態系統,以便對臨床試驗數據進行更佳管理,並提供更大程度 的數據模塊化以及對收集自多項臨床試驗的數據作出更廣泛的潛在應用。通過使用創新 數碼工具,生物制藥公司可借助其臨床數據進行先進的數據分析及優化日後研發決定。
臨床數據管理維持良好增長。根據弗若斯特沙利文,針對數據管理及統計數據分析市場, 美國從 2015 年至 2019 年實現了 9.4%的年均複合增速,而中國則實現了 23.5%的高增速。 預計從 2019 年至 2024 年,中國市場有望實現 25.7%的年均複合增速。至 2024 年,美國 臨床數據市場規模有望達到 49.29 億美元,而中國則有望達到 15.24 億美元,中國增速 顯著高于美國。臨床合同研究機構通常在境外提供數據管理及統計數據分析,以應付主 要來自美國有關服務的外包需求。鑒于中國擁有龐大的統計學及生物科學人才庫及相對 具競爭力的勞工成本,中國的合同研究機構在提供數據管理及統計數據分析服務方面處 于有利競爭地位。進行數據管理及統計數據分析須符合的資格包括具備可靠數據、編寫 程序及統計數據的能力、必要醫療及臨床知識以及對相關監管規定的充分了解。臨床合 同研究機構能夠在全球物色數據管理及統計數據分析項目,再由專門從事有關工作的更 集中團隊實施有關項目。由于擁有龐大且日益增長專精于數據管理及統計數據分析的人 才庫,以及國內需求不斷增加,預期中國將逐漸獲得更多全球市場份額。
中國臨床試驗現場管理(SMO)市場未來有望實現近 40%增速。臨床試驗現場管理通常指 臨床試驗現場管理組織,與患者招募服務爲生物制藥公司及研究機構提供多樣化的支持 服務,包括代表臨床研究機構招募健康志願者與患者參與臨床試驗,特別是在中國執行 臨床試驗及管理試驗相關的文件存盤及數據。中國臨床試驗現場管理組織市場的增長主 要歸因于①臨床研究醫生及專業人士短缺。執行臨床試驗涉及工作量龐大的冗長技術流 程。在中國,臨床試驗機構主要爲醫院。中國的醫院普遍將大部份資源分配至門診及住 院職務,醫院工作的醫生與護士管理在其所在醫院進行的臨床試驗能力有限,因而産生 對專業現場管理組織的需求,可提供經驗豐富的人員(稱爲臨床研究協調員或「臨床研 究協調員」)支持醫生與護士執行及管理臨床試驗。②改革臨床試驗管理及愈來愈嚴格 的臨床試驗中心質量規定。自 2019 年發布《藥物臨床試驗機構管理規定》以來,中國 計劃在管理臨床試驗方面由資格認證制度轉換爲注冊制度。預計過往未經許可進行臨床 試驗的合資格醫院可根據建議的新制度注冊進行臨床試驗。現場管理組織透過提供全面 的臨床研究協調員資源及研究員培訓服務,爲該等醫院提供臨床研究能力。此外,由于 現場管理的質量控制計劃漸趨嚴謹,預期臨床試驗現場管理組織將受惠于該不斷增加的 需求,可助醫院在良好臨床規範的框架下改善質量控制及遵規情況。
患者招募服務市場持續增長。中國患者招募服務市場增長主要歸因于①龐大且具經濟效 益但分散的患者群。中國擁有相對大量的全面疾病譜患者。與大多數發達國家相比,中 國患者進行臨床試驗的人均成本亦較低。然而,中國的患者分散且遍布全國,因而造就 對可助生物制藥公司在全國篩選、鑒別、定位及招募患者且網絡廣大的患者招募服務提 供商的需求持續上升。②患者招募競爭加劇。隨著中國的臨床試驗數量急速增長,在相 同或類似組別的患者之間爲各臨床試驗招募患者的競爭不斷加劇。爲確保患者招募過程 適時進行且具成本效益,許多生物制藥公司選擇委聘第三方患者招募服務提供商,以按 具成本效益的方法加快患者招募的過程。
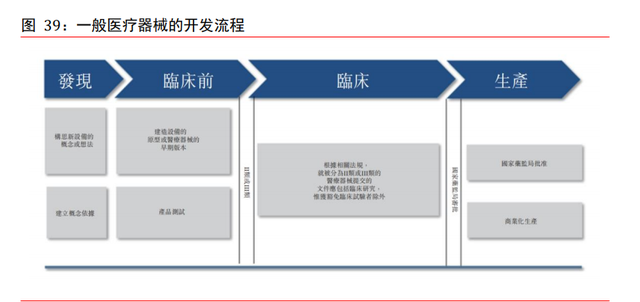
醫療器械 CRO 市場簡介。醫療器械指旨在供人類用作醫療目的之設備,一般按風險水平 的基准分爲三類。一般而言,I 類器械對患者及╱或使用者的風險屬低,並不存在不合 理的疾病或受傷風險(例如,彈性繃帶)。II 類器械一般具有中等風險(例如,輸液泵)。 III 類器械具有較高風險,通常供植入人體以直接維持生命(例如,起搏器)。醫療器 械研發流程包括發現、臨床前、臨床及生産階段。II 類及 III 類醫療器械均須進行臨床 試驗以取得國家藥監局批准,亦可能須進行批准後研究,以進一步評估有關設備對更大 量患者的安全概況。合同研究機構提供的醫療器械外包服務包括①早期設備開發及産品 設計;②臨床試驗;③監管批准(如産品測試及監管咨詢);及④上市後支持。
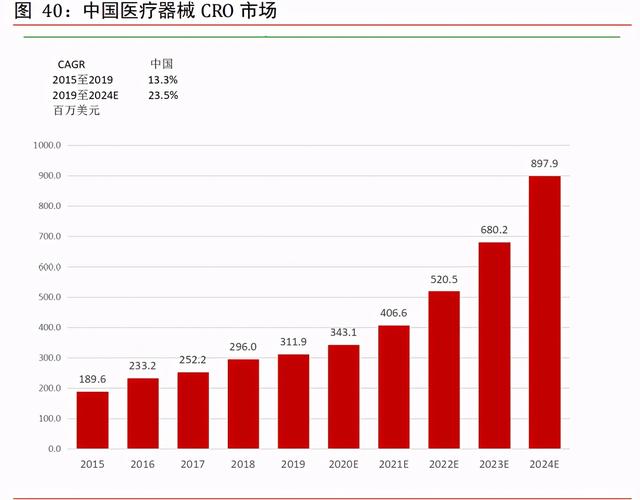
中國醫療器械 CRO 市場延續高增長率。根據弗若斯特沙利文,2019 年中國醫療器械 CRO 市場規模首次超越 3 億美元門檻,達到了 3.12 億美元。預計至 2024 年該市場規模接近 9 億美元附近,2019 年至 2024 年的 CAGR 爲 23.5%,增長率對比以往有所放大。
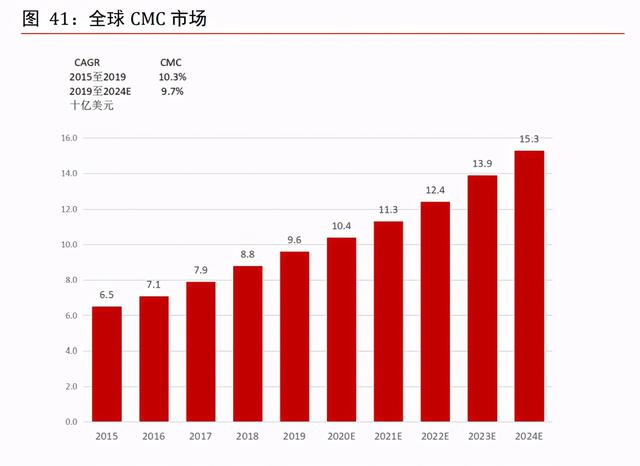
中國 CMC 市場增速維持 20%以上。于臨床前及臨床階段,合同研究生産機構主要提供 CMC 服務。鑒于近年醫療健康行業持續增長,全球 CMC 市場由 2015 年約 65 億美元增至 2019 年的 96 億美元,預計 2024 年將進一步增至 153 億美元,2019 年至 2024 年的複合年增 長率爲 9.7%。與全球 CMC 市場相比,中國 CMC 市場仍處于相對早期階段,過往五年經曆 快速增長,預計 2024 年將進一步增至 30 億美元,2019 年至 2024 年的複合年增長率爲 24.6%。
3.5 中國 CMO 行業增速有望維持約 30%
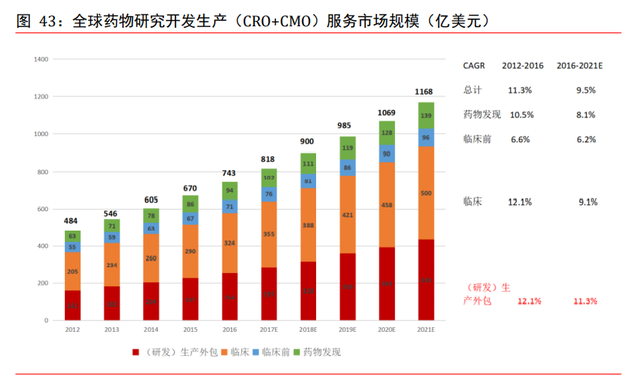
全球 CMO 市場增速超 10%。在研發成本增加和專利懸崖的雙重壓力下,同時受到自身研 發人才限制的影響,藥企更傾向于選擇醫藥研發生産外包服務降低産品開發的成本,提 升公司研發效率。醫藥研發投入的不斷增加亦爲研發生産外包服務的市場發展提供了堅 實基礎與保證。全球藥物發現有望繼續維持高增長率,預計從 2016 至 2021 年,藥物發 現環節將保持 8.1%的年複合增長率,臨床前環節保持 6.2%的年複合增長率,臨床環節 保持 9.1%的年複合增長率,生産外包環節保持 11.3%的年複合增長率,生産外包環節增 速高于其他環節。
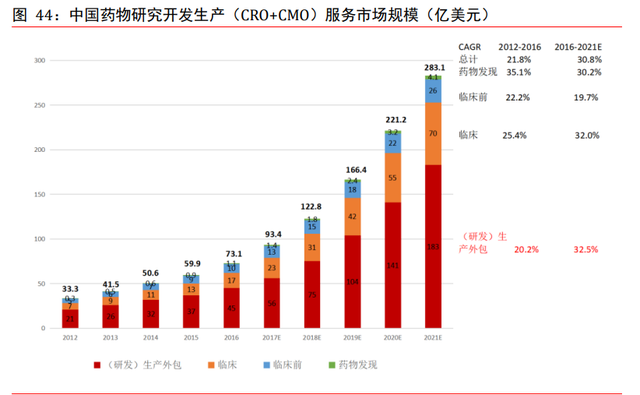
預期中國 CMO 市場增速有望超 30%。中國藥物研究開發生産外包服務市場規模近年也維 持高速增長,增速高于全球水平。預測從 2016 至 2021 年,中國 CRO+CMO 市場有望維持 30.8%的年均複合增速,遠高于全球平均水平的 9.5%。分環節看,臨床前階段有望維持 19.7%的年均複合增速,臨床和生産外包階段分別有望維持 32.0%和 32.5%的年均複合增 速。
4、老齡化與創新藥推動,外包行業景氣度有望持續
多因素促進醫藥外包行業高速增長。人口老齡化、慢性病患者數量的不斷增加、醫療總 花費的持續上升、醫療保障系統的完善、醫藥行業風險資本投入加大,都是全球和中國 醫藥市場維持穩定增長的驅動力。藥物研發服務行業將伴隨醫藥市場不斷成長,並爲醫 藥市場發展提供助力,不斷滿足患者、藥企研發以及行業創新的需求,促進外包行業高 速發展。
4.1 人口老齡化是中國醫藥市場快速增長的根本因素
4.2 醫療衛生總支出快速增加
4.3 社會風險資本長期看好創新藥物研發領域
4.4 獲批新藥數量近年維持高位
FDA 新藥通過數量維持高位水平。2019 年,FDA 的藥品評價和研究中心(CDER)批准了 48 個 NDA 和 BLA 申請,以及 96 個首仿藥;48 個首次 NDA 和 BLA 申請中有 37 個新分子實體, 21 個孤兒藥,24 個藥獲優先評審。對比 2018 年的 59 個,2019 年整體數量小幅下滑但 仍維持了曆史第二高位。
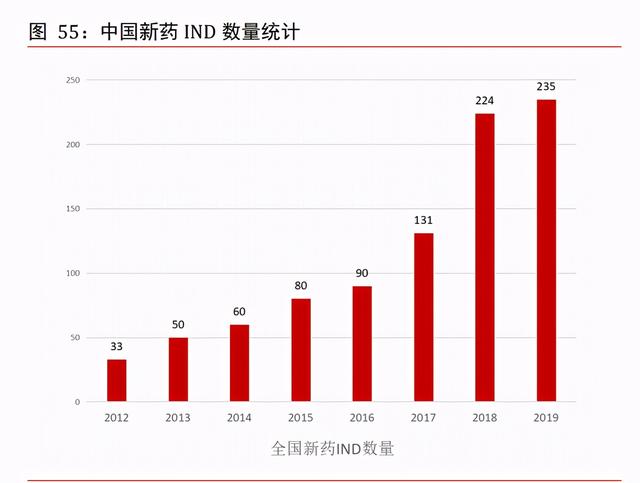
國産新藥臨床申請數量快速增加。我國國産新藥臨床申請(IND)申報數量在 2003-2012 年的十年之間僅維持在每年 30 個左右,到 2012 年國産新藥臨床申請數量爲 33 個。2012 年之後我國國産新藥 IND 申請數量開始呈現加速增長,到 2017 年國産新藥臨床申請數 量增長至 131 個,相比 2016 年提升了 46%,到 2018 年國産新藥臨床申請再度大幅攀升, 達到 224 個,相比 2017 年提升了 71%。2019 年,國産新藥臨床申請(IND)數量持續爆 發,達到 235 個。
4.5 中國藥企研發支出保持高增長,爲 CXO 行業提供上層支撐
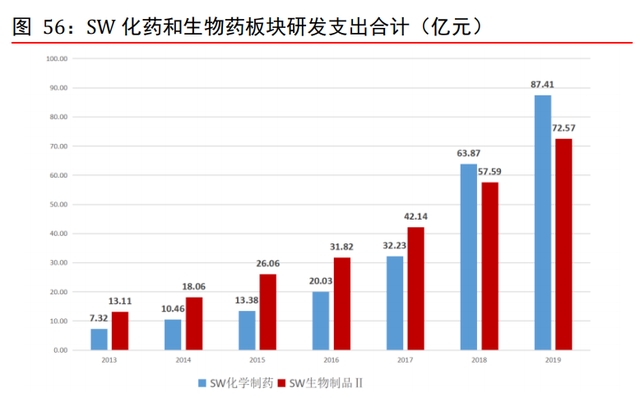
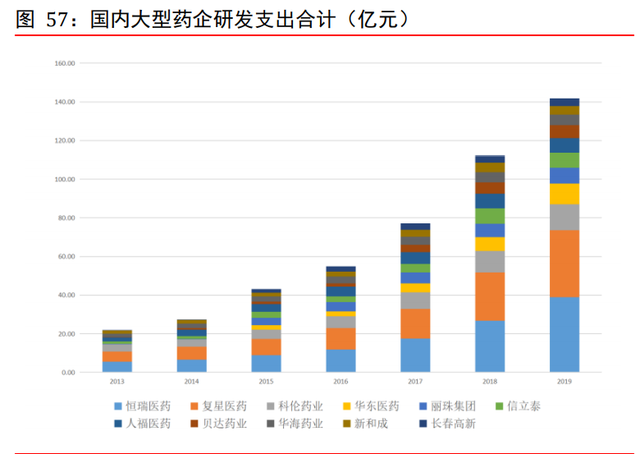
國內大型藥企研發支出保持高增長。在新一輪藥政改革的背景下,我國醫藥行業研發投 入增幅較快,國內醫藥企業研發投入保持了較高的增幅水平。根據 wind,從 2013 年至 2019 年,SW 化學制藥板塊研發支出從 7.32 億元提升至 87.41 億元,CAGR 爲 51.18%; SW 生物制品板塊研發支出從 13.11 億元提升至 72.57 億元,CAGR 爲 33.00%。具體到企 業層面,國內大型藥企如恒瑞醫藥、複星醫藥、科倫藥業等,研發支出均保持每年快速 增長,爲 CXO 行業提供上層支撐。
4.6 新藥研發成本持續上升,成功率逐年下降,降本提速需求激增
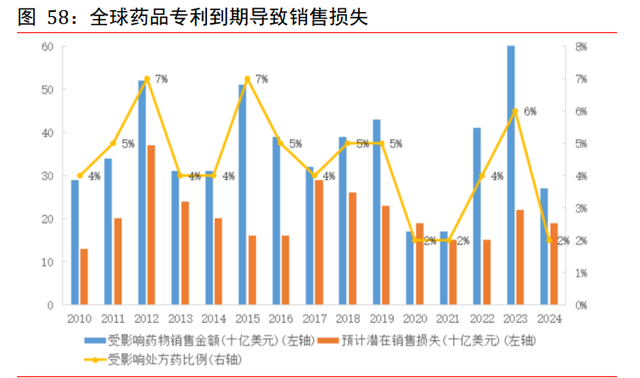
全球藥品專利到期導致銷售損失。一款新藥從藥物發現階段到上市投産階段,一般需要 10-15 年的研發時間,世界主要國家的新藥專利保護期都爲 20 年,新藥上市之後實際有 效的專利保護期限基本僅剩 6-10 年。專利到期後,隨著仿制藥企業的進入,專利藥物 面臨巨大的價格壓力,醫藥公司盈利將受到較大影響。根據 FDA 藥品數據庫資料,2011 至 2020 年將有 1,309 項藥物基本化合物專利期滿,涉及近兩百個藥品。其中 2011 年至 2014 年爲藥品基本專利到期的高峰時間,涉及上百個藥品的 80 件核心專利,主要分布在抗感染、內分泌調節、神經系統和心血管領域。根據 FDA 數據,2014 年全球有 326 項 藥物基本化合物專利期滿,達到曆年到期專利數量的巅峰;2015 年還有 293 種原研藥迎 來專利期的結束。根據 EvaluatePharma 的研究數據,在 2010-2024 年間,由于專利到 期將造成全球藥企約 3,140 億美元的銷售額損失。
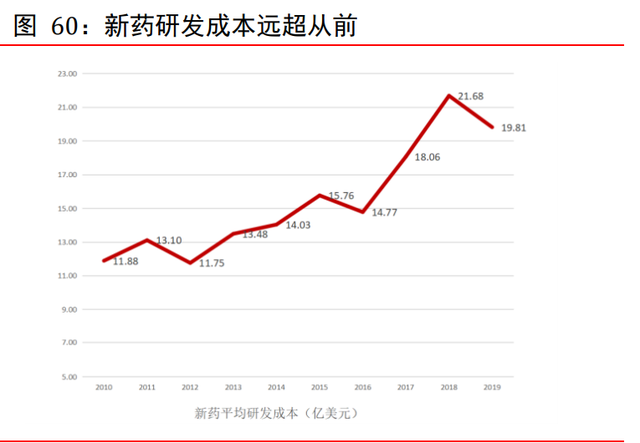
醫藥研發回報率創新低。德勤統計顯示,1)2019 年全球 TOP12 醫藥企業在 R&D 上的投 資回報率僅有 1.8%,是連續 10 年報告數據裏的最低值,對比 2010 年的 10.1%降幅巨大。 2)新藥平均研發成本上提升快速,從 2010 年的 11.88 億美元提升到了 2019 年的 19.81 億美元,增幅高達 66.75%。3)新藥上市以後的平均銷售峰值預測從 2010 年的 8.16 億 美元下降到 2019 年的 3.76 億美元,降幅同樣超過一半。4)TOP12 公司後期管線資産的 數量逐漸減少,在 2018 年達到最低點 159 個,平均每家 13.25 個。從 2010 年至 2019 年,這些公司的每家平均後期管線資産的數量從 17 個下降到了 15 個。這些數據都表明 了藥企研發壓力大,盈利難度遠超從前。
CRO 行業降低藥企研發成本作用凸顯。CRO 行業存在的主要目的是解決藥企研發困局, 提高效率並降低成本。隨著醫藥市場競爭越發激烈,藥品研發耗時越來越長、成功率越 來越低、投入成本越來越高、專利懸崖越來越嚴重,越來越多大小藥企選擇分拆非核心 的藥品研發業務外包給專業 CRO 機構,從而達到提高研發效率、降低失敗風險及控制成 本投入的研發目的。産業信息網數據顯示,藥企通過與 CRO 合作,可實現高達 40%研發 成本的降幅,並節約 10-20%的臨床試驗時間。國內 MAH 制度落地,藥企業務重點更加偏 向研發流程,傾向把重要性相對較低的生産環節外包給 CDMO 企業進行,實現藥物研發 和生産的分離,減輕研發壓力。此外,由于國內存在明顯的人力、物力成本優勢,在臨 床前研究及臨床研究各階段研發費用僅爲發達國家的 30%-60%,對于跨國藥企而言有較 強的吸引力。
4.7 政策層面持續鼓勵醫藥創新,研發外包行業迎來絕好機會
多項政策出台加快創新藥發展。近年來醫藥政策頻出,從醫藥工業發展規劃到外包服務 發展綱要,從審評改革到創新藥優先評審,從 MAH 試點到一致性評價等,政策出台逐步 壓縮傳統仿制藥利潤空間,持續推動中國醫藥産業從“仿制藥”時代向“創新藥”時代 轉型。2017 年《國際服務外包産業發展“十三五”規劃》指出,著力提升新藥研發全程服務水平和創新能力,完善醫藥研發服務鏈,提升符合國際規範的綜合性、多樣化的醫 藥研發水平。優化醫藥和生物技術研發服務結構,發展藥物産品開發、臨床前試驗及臨 床試驗、國際認證及産品上市輔導服務等業態,切實利好醫藥外包行業。創新藥政策則 從側面利好醫藥外包行業發展,創新藥相關政策,正逐步促使以仿制藥爲主的企業逐步 轉型創新藥研發。創新藥研發過程中服務外包是不可或缺的一部分,重點發揮了增效降 本的實際作用,據統計藥企通過與 CRO 合作,可實現高達 40%研發成本的降幅,並節約 10-20%的臨床試驗時間。並且,研發外包行業有一定的政策免疫性,個別品種藥品或器 械類別受相關負面政策影響,並不會影響外包企業整體經營狀況。未來,醫藥外包服務 行業跟隨中國創新藥發展大潮流,在持續爲創新藥研發貢獻中有望長期受益。
5、重點公司分析與對比(略)
6、投資策略
給予 CXO 行業推薦評級,重點關注頭部企業和細分龍頭。①從發展曆程看,中國 CXO 行 業曆史僅約 20 年,大致度過了起步期的業務探索階段,開始進入高速發展期,企業間 的並購整合活動頻繁。②從業務範圍看,中國 CXO 行業已覆蓋新藥研發所有階段;以藥 明康德爲首的大型外包企業憑借規模優勢和並購,進行新藥研發全産業鏈布局,客戶訂 單延續性高;以泰格醫藥爲首的細分龍頭,鞏固主營環節優勢的同時,開始逐步嘗試延 伸業務版圖至相近環節。③從費用分布看,臨床階段研發費用占比最高,疊加中國市場 有龐大的患者基數,是 CXO 企業熱衷的拓展環節。④從上遊醫藥研發支出看,全球研發 支出維持正增長,中國藥品研發支出預期維持 20%以上的年均增速,CXO 行業將直接受 益于上遊研發投入高增長。⑤從 CXO 行業增速看,根據弗若斯特沙利文,中國市場臨床 前、臨床、CMC 三個主要環節未來數年有望分別實現 30%、20%、20%年均增速,高于往 年數據,行業維持高景氣度。⑥從行業滲透率看,由于發展較發達國家晚,中國外包行 業目前滲透率在 35%左右,未來仍有很大上升空間。⑦從行業意義看,新藥研發投入大、 周期長、成功率低、競爭大、回收率下滑等沖擊,藥企越來越傾向選擇分拆非核心的藥 品研發業務和生産環節給予 CXO 企業進行,從而達到降本增效的目的。⑧從未來趨勢看, 中國人口老齡化加速、醫療總花費的持續上升、醫藥行業風險資本投入加大等因素,將 促使醫藥行業維持景氣,爲 CXO 行業提供持久的驅動力。⑨從競爭優勢看,中國 CXO 企 業憑借本土數量巨大的醫藥行業人才資源和相對低廉的用人成本,加上國際互認的推 行,對比外企有顯著的競爭優勢。⑩從政策層面看,持續鼓勵創新藥、集采全國推行、 MAH 制度落地、開展一致性評價、科創板放寬醫藥生物企業入門等政策的相繼實施,實 則離不開鼓勵醫藥創新,促使中國醫藥行業從仿制藥時代向創新藥時代變革,而 CXO 行 業將參與醫藥創新的過程並收獲成果。綜上所述,CXO 行業景氣度高漲,且增長拐點尚 未可見,首次給予 CXO 行業整體“推薦”評級。建議優先關注頭部企業和細分龍頭,如 藥明康德、康龍化成、泰格醫藥、凱萊英、昭衍新藥等。
……
(報告觀點屬于原作者,僅供參考。作者:東莞證券,魏紅梅)
【報告來源:未來智庫】