9 月 2 日,美國 FDA 宣布批准阿斯利康的 PD-L1 單抗「度伐利尤單抗」新適應症,聯合化療一線治療膽道癌。
度伐利尤單抗是近 10 年來首個在一線膽道癌全球 III 期臨床中取得 OS 突破的免疫療法。本次批准有望撼動膽道癌一線標准化療的地位,爲相應患者帶來更好的生存獲益。
來自:FDA 官網
膽道腫瘤(BTC)是起源于膽囊及膽管的惡性腫瘤的總稱,其發病率約占所有消化系統腫瘤的3%。其分型包括膽囊癌(GBC)、肝內膽管癌(ICC)和肝外膽管癌(ECC),ECC 根據解剖位置又分爲肝門部膽管癌(PCC)和遠端膽管癌(DCC)。
目前,BTC 全球發病率呈現上升趨勢,以亞洲國家最爲常見。其中,以 GBC 最爲常見,全球發病率位居消化道腫瘤第6位;近年來我國 ICC 發病率也在逐年升高。
由于 BTC 起病隱匿,侵襲性強且對常規放化療不敏感,因此 BTC 的預後極差,5 年生存率僅5%-15%。長期以來,晚期 BTC 的一線標准治療都是以吉西他濱聯合順鉑(GC)化療方案爲主,然而其臨床療效並不盡如人意。
此前,FDA 僅批准了 3 款膽道癌靶向藥,而未有免疫療法獲批。這三款膽道癌治療藥物都在 2020 年及 2021 年才剛剛獲批,其中兩款爲 FGFR 抑制劑,信達/Incyte 的佩米替尼(Pemigatinib)和聯拓/BrigeBio 的 Infigratinib;一款爲 IDH1 抑制劑艾伏尼布,由Agios Pharmaceuticals開發,基石藥業引進。目前佩米替尼和艾伏尼布已經在國內獲批上市。
全球獲批上市的膽道癌靶向化藥
來自:Insight 數據庫網頁版
免疫療法在膽道癌進展不算順利,甚至可以說坎坷,2021 年默克的 PD-L1/TGFβ雙特異性融合蛋白 M7824 在這一適應症上慘遭一線二線二連敗。
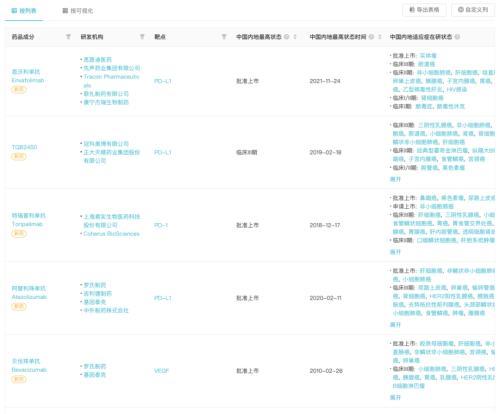
而據Insight 數據庫顯示,除度伐利尤單抗外,全球另有 5 款抗體藥針對膽道癌在開展III 期臨床,國內企業沖在最前線 ,包括正大天晴的 TQB2450、康甯傑瑞/思路迪的恩沃利單抗和君實的特瑞普利單抗。
這三者在療法類型則各有區別:TQB2450 聯合安羅替尼二線治療膽管癌、恩沃利單抗聯合化療一線治療膽道癌、特瑞普利單抗則聯合侖伐替尼和化療用于膽管癌新輔助治療。
膽道癌領域抗體藥研發進度(臨床 III 期)
來自:Insight 數據庫網頁版
作爲首個在一線膽道癌全球 III 期臨床中取得積極結果的免疫療法,Imfinzi 此前也憑借這項適應症獲得 FDA 孤兒藥資格認定。本次批准之後,膽道癌患者終于迎來了新的一線治療方案。
Imfinzi:延長患者 OS
降低疾病進展或死亡的風險25%
阿斯利康最早于 2021 年 10 月宣布度伐利尤單抗聯合化療一線治療晚期膽道癌(BTC)的 III 期臨床 TOPAZ-1 在中期分析中達到了總生存期(OS)主要終點,次年1 月 18 日在 2022 ASCO GI 上公布了 TOPAZ-1 研究數據。
TOPAZ-1是一種隨機、雙盲、安慰劑對照全球多中心 III 期臨床試驗,評估 Imfinzi 聯合化療(吉西他濱+順鉑)相較于安慰劑聯合化療一線治療不可切除的晚期或轉移性 BTC 患者的療效和安全性。該試驗在全球納入685 名患者,主要終點爲總生存期(OS),關鍵次要終點包括無進展生存期(PFS)、客觀緩解率(ORR)以及安全性。
在預先確定的中期分析中,與單獨化療相比,接受Imfinzi 聯合療法的患者死亡風險降低了 20%(基于 0.80 的風險比 [HR];95% 置信區間 [CI],0.66-0.97;雙側 p=0.021)。中位 OS 爲 12.8 個月,而化療爲 11.5 個月。25% 的患者在兩年內仍存活,而接受化療的患者爲 10%。
結果還顯示, Imfinzi 聯合化療可使疾病進展或死亡的風險降低 25%(HR,0.75;95% CI,0.64-0.89;雙側 p=0.001)。聯合治療的中位 PFS 爲 7.2 個月,而化療爲 5.7 個月。接受 Imfinzi 聯合化療的患者的客觀緩解率 (ORR) 爲 26.7%,而單獨接受化療的患者的 ORR 爲 18.7%。
安全性方面,Imfinzi聯合化療耐受性良好,與對照組相比具有相似的安全性,並且與單獨化療相比,不會增加因不良事件導致的停藥率。
TOPAZ-1 臨床試驗結果
來自:Insight 數據庫網頁版
5 月 4 日,阿斯利康宣布 PD-L1 單抗 Imfinzi(度伐利尤單抗)聯合化療一線治療膽道癌的新適應症上市申請(sBLA)獲 FDA 受理,並授予優先審評。僅隔 4 個月,這項新適應症就通過FDA 腫瘤學卓越中心的 Orbis 項目獲得批准。FDA 新聞稿中表示,這項審評中也與澳大利亞,加拿大,新加坡和瑞士的監管機構進行了合作。
本文源自Insight數據庫